INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
GUÍA DE TRABAJO - AREA DE INGLÉS
GRADOS SEXTOS
DOCENTE OLGA PATRICIA MONJE
learning.educacion@gmail.com
DOCENTE OLGA PATRICIA MONJE
learning.educacion@gmail.com
1. En los espacios en blanco escriba sus datos personales en inglés de acuerdo a la información solicitada (personal information).
A. Full name: ___________________ ____________________
(name) (last name)
B. Address: __________________________
C. Ocupation: ________________________
D. Age:______________
E. Place of Birth: _____________________
2. Responda a las siguientes preguntas en inglés:
A. What is your name? __________________________
B. How old are you? ____________________________
C. When is your birthday? ________________________
D. What is your address? _________________________
E. Where are you from? __________________________
3. Ordena las siguientes palabras y forma la pregunta correctamente. Luego respóndalas en inglés:
A. Time / the / is / what / concert / ? ________________________ / ______________________________
B. Name / your / fathers / is / what / ? _______________________/ ______________________________
C. When / birthday / your / is / ? ___________________________ / ______________________________
D. Are / the apples / what color / ? __________________________/ ______________________________
E. Your brothers / are / how old / ? __________________________/ ______________________________
4. Complete las siguientes oraciones afirmativas empleando el verbo To be en tiempo presente, luego escríbalas en forma negativa (ver To be in present tense):
A. I _____ 10 years old.
B. You ______ an English teacher.
C. My computer _____ new.
D. It _____ in my house.
E. Manuel and Mike _______ in the laboratory.
Negative form:
A. ____________________________
B. ____________________________
C. ____________________________
D. ____________________________
E. _____________________________
5. Responda la siguiente pregunta de acuerdo a lo observado (guíese por el ejemplo):
A. What are they doing?
They are playing
_____________________
B. What is he doing?
______________________
C. What is she doing?
__________________
D. What are you doing?
_____________________
______________________
6. Elabore un diálogo de una página donde intervenga máximo tres personas. Debe emplear:
Ø Saludos y despedidas (Greetings and farewells)
Ø Verbo To Be en tiempo presente (verb To be in present tense)
Ø Información personal (personal information)
Ø Preguntas y respuestas usando WH (Questions and answers using WH)
NOTA: DEVOLVER SOLUCION DEL TALLER AL CORREO
learning.educacion@gmail.com prof.olga patricia
Grado: 603 JM
Asignatura: Castellano
Profesor: Olimpo Gallo H.
Temas:
Géneros literarios
1. Narrativos
2. Lírica
3. Teatral
2. El texto descriptivo
3. Tradicional oral.
Cultura Indígena
Cultura Afrocolombiana
4. Principales categorías gramaticales de la oración.
Sujeto, predicado, Verbo, Sustantivo, Adjetivo.
Actividades:
1. En su cuaderno transcriba un párrafo y una estrofa y un diálogo (corta) y señale en ellos y las diferencias entre sí.
2. Elabore un texto de temática libre (No mayor de 15 renglones ni menor de 10); y en el identifique la idea principal.
3. Escuche la canción: “Yo me llamo Cumbia” de Mario Gareña en ella identifique sus principales características en cuanto a la letra .
4. Elabore 10 oraciones y con diferentes colores subraye las categorías gramaticales antes mencionadas.
GRADO SEXTO
ASIGNATURA DE BIOLOGÍA
PRIMER PERÍODO
PROFESORA: LIC: NOHORA NARNHAEZ L
UNIDAD : ESTRUCTURA CELULAR.
TEMAS:
-
COMPETENCIAS A DESARROLLAR: Básicas, científicas, interpretativas, comprensión, argumentación y proposición.
ESTANDAR: Reconozco los avances científicos y su aplicación en la teoría celular y clasificación de los seres vivos.
OBJETIVO: Explico la estructura de la célula y las funciones básicas de sus componentes.
ESTUDIANTE: ________________________________________________________ GRADO:______
FASE I: IDEAS PREVIAS.
SITUACIÓN DE APRENDIZAJE.
UN TOUR POR LA CELULA.
-Nos iremos de viaje!!!- exclamó Azucarita a su mamá- Era un día perfecto para viajar. Después de haber vivido muchas aventuras en sus últimos viajes, al fin llegaría al lugar deseado. Preparó maletas y despidiéndose de su madre Doña Cañita siguió su camino. Lo que no imagino Azucarita era que al llegar, la entrada a este lugar fuese tan difícil. Una enorme cubierta protegida por puertas cerradas le impedía entrar, sin embargo, al intentar hacerlo, le hicieron muchas preguntas para determinar que no fuese a ser un mal para la célula. Al preguntar porque tanto requisito, solo obtuvo como respuesta que era un puesto de control, orden de la Membrana celular. Al entrar sintió como se sumergió en una sustancia pegajosa y gelatinosa donde flotaban todos los lugares que visitaría. Como buena joven inquieta al preguntar dónde se encontraba- todos le respondieron en coro- estamos en el Citoplasma!!!, así siguió visitando cada uno de los lugares y fue como se dio cuenta que al llegar a un lugar esférico, llamado el núcleo donde se encuentra la información hereditaria de la célula en la forma de ADN, siglas de ácido desoxirribonucleico . Siguió su viaje al Nucléolo, encontró que es un lugar redondeado u ovalado, fácilmente observable incluso con el microscopio óptico en el núcleo de las células eucariotas; estructurado por cromatina para la producción de ARNr (ácido ribonucleico ribosomal). Se sentía fatigada, era necesario conseguir un transporte para continuar su viaje. Vio pequeños sacos que se transportaban sobre caminos membranoso, -tomare ese transporte – pensó - y fue cuando se dio cuenta que estaba en el Aparato de Golgi. Allí sacos membranosos con vesículas esféricas en sus extremos, situado cerca del núcleo, transportaban los compuestos sintetizados al exterior de la célula. Noto como el aparato de Golgi está conectado a la membrana citoplasmática para trasladar o viajar contenidos fuera de la célula. Continuo su viaje caminando, y fue así como al llegar a un sitio donde existían lugares más o menos esféricos, distribuidos en la matriz citoplasmática o unidos a las membranas del retículo endoplasmático. Eran los ribosomas que están constituidos por ARN (ácido ribonucleico) y proteínas. Además, es el lugar donde se realiza la síntesis de proteínas y enzimas. Atravesó por lugares que le dieron algo de miedo y que prefirió ignorar, al preguntar por estos lugares se enteró que era el Retículo endoplasmático, el cual se divide en retículo endoplasmático liso y retículo endoplasmático granular, en este lugar ocurre el intercambio de materia entre la matriz y la cavidad interna e interviene en la síntesis de proteínas al relacionarse con los ribosomas.
Ya agotada, Azucarita llego a un lugar que le causo cierto temor pero que también llamó poderosamente su atención. Este lugar estaba formado por una doble membrana una externa lisa y otra interna plegada formado crestas. En el interior de este lugar se encontraron proteínas, enzimas y ATP. Las mitocondrias se encuentran diseminadas en el citoplasma de la célula, su función radica en generar ATP, o sea energía a partir de la respiración celular en el llamado ciclo de Krebs. Se les conocen como las fábricas de energía. Azucarita noto como entraba en un largo sueño producido tal vez por su largo viaje. Cansada se dejó llevar por esta sensación y sintió como era abrazada por moléculas de oxígeno y llevada a un hermoso lugar donde explotaba en luces de colores y gotas de lluvia caían suavemente al suelo. Se había dado la respiración celular, y había pasado a ser ENERGIA.
ACTIVIDAD: Resuelve las siguientes preguntas en base a la lectura anterior.
1. Resume la lectura mediante un mapa conceptual.
2. Realiza un dibujo que muestre todo el recorrido que realizó Azucarita por la célula.
FASE III: TEORÍA.
La Célula. Estructura Y Función.
Hasta el final del s. XIX no se elaboró la teoría celular, que enuncia que la célula es la unidad morfológica, fisiológica y genética de todos los seres vivos, y que además toda célula proviene de otra. Todas las células tienen una estructura común: la membrana plasmática, el citoplasma y el material genético o ADN. Se distinguen dos clases de células: las células procariotas (sin núcleo) y las células eucariotas, mucho más evolucionadas y que presentan núcleo, citoesqueleto en el citoplasma y orgánulos membranosos con funciones diferenciadas.
Forma y tamaño de las células
La célula es una estructura constituida por tres elementos básicos: membrana plasmática, citoplasma y material genético (ADN). Las células tienen la capacidad de realizar las tres funciones vitales: nutrición, relación y reproducción (ver t13).
La forma de las células está determinada básicamente por su función. La forma puede variar en función de la ausencia de pared celular rígida, de las tensiones de uniones a células contiguas, de la viscosidad del citosol, de fenómenos osmóticos y de tipo de citoesqueleto interno.
El tamaño de las células es también extremadamente variable. Los factores que limitan su tamaño son la capacidad de captación de nutrientes del medio que les rodea y la capacidad funcional del núcleo.
Cuando una célula aumenta de tamaño, aumenta mucho más su volumen (V) que su superficie (S) (debido a que V = 4/3pr3 mientras que S = 4/3pr2). Esto implica que la relación superficie/volumen disminuye, lo que es un gran inconveniente para la célula ya que la entrada de nutrientes está en función de su superficie y no del volumen. Por este motivo, la mayoría de las células maduras son aplanadas, prismáticas e irregulares, y pocas son esféricas, de forma que así mantienen la relación superficie/volumen constante. El aumento de volumen de la célula nunca va acompañado del aumento de volumen del núcleo, ni de su dotación cromosómica.
Célula procariota: bacteria Gram positiva.
Célula eucariota. Epitelial secretora.
Estructura de las células.
La estructura común a todas las células comprende la membrana plasmática, el citoplasma y el material genético o ADN.
Membrana plasmática: constituida por una bicapa lipídica en la que están englobadas ciertas proteínas. Los lípidos hacen de barrera aislante entre el medio acuoso interno y el medio acuoso externo.
El citoplasma: abarca el medio líquido, o citosol, y el morfoplasma (nombre que recibe una serie de estructuras denominadas orgánulos celulares).
El material genético: constituido por una o varias moléculas de ADN. Según esté o no rodeado por una membrana, formando el núcleo, se diferencian dos tipos de células: las procariotas (sin núcleo) y las eucariotas (con núcleo).
Las células eucariotas, además de la estructura básica de la célula (membrana, citoplasma y material genético) presentan una serie de estructuras fundamentales para sus funciones vitales (ver t27 y t28):
El sistema endomembranoso: es el conjunto de estructuras membranosas (orgánulos) intercomunicadas que pueden ocupar casi la totalidad del citoplasma.
Orgánulos transductores de energía: son las mitocondrias y los cloroplastos. Su función es la producción de energía a partir de la oxidación de la materia orgánica (mitocondrias) o de energía luminosa (cloroplastos).
Estructuras carentes de membranas: están también en el citoplasma y son los ribosomas, cuya función es sintetizar proteínas; y el citoesqueleto, que da dureza, elasticidad y forma a las células, además de permitir el movimiento de las moléculas y orgánulos en el citoplasma.
El núcleo: mantiene protegido al material genético y permite que las funciones de transcripción y traducción se produzcan de modo independiente en el espacio y en el tiempo.
Los Orgánulos Celulares
El sistema endomembranoso delimita compartimentos u orgánulos con funciones muy definidas dentro de la célula: el retículo endoplasmático, el aparato de Golgi, los lisosomas y los peroxisomas. Los orgánulos productores de energía (mitocondrias y cloroplastos en plantas) desempeñan funciones fundamentales para la célula. Las membranas también forman vesículas que se mueven de unos orgánulos a otros y hacia el interior o exterior celular (endocitosis, exocitosis), lo que incrementa la superficie efectiva de la célula para el intercambio de materia con el exterior.
El retículo endoplasmático
Es un sistema membranoso compuesto por una red de sáculos aplastados o cisternas, vesículas y túbulos sinuosos. Se halla comunicado con la envoltura nuclear y se extiende por todo el citoplasma de la célula, teniendo un único espacio interno denominado lumen. Se distinguen dos clases de retículo endoplasmático, según sus funciones y su composición:
Retículo endoplasmático rugoso (RER):
Presenta ribosomas anclados en la membrana, en su cara citosólica. Está formado por cisternas y vesículas, que salen de dichas cisternas, y está comunicado con la membrana nuclear y con el retículo endoplásmático liso.
Su función principal es la síntesis de proteínas mediante los ribosomas anclados en su membrana. Las proteínas se translocan al lumen e inician una ruta biosintética que las transportará, a través de vesículas, a otros orgánulos o bien a la membrana plasmática.
Retículo endoplásmático liso (REL):
Su estructura carece de ribosomas. Está formado por una red de túbulos unidos al RER, que se extiende por todo el citoplasma. La función principal del REL es la síntesis de todos los lípidos constituyentes de las membranas: colesterol, fosfolípidos, glucolípidos, etcétera. Sólo los ácidos grasos se sintetizan en el citosol.
Origen del aparato de Golgi y los lisosomas.
Aparato de Golgi
Está formado por uno o varios dictiosomas, que son una agrupación en paralelo de cuatro a ocho sáculos discoidales o cisternas membranosas. Está polarizado, ya que el dictiosoma presenta una cara cis, próxima al RER, y una cara trans, próxima a la membrana plasmática. Entre las cisternas hay un tráfico de vesículas; la cara cis recibe vesículas de transición que provienen del retículo endoplasmático. El contenido del dictiosoma va avanzando hacia la cara trans de maduración, mediante vesículas intercisternas. El contenido de las cisternas de la cara trans se acumula en el interior de vesículas de secreción que podrán fusionarse con lisosomas o bien secretarse al medio extracelular por exocitosis. El aparato de Golgi continúa la ruta biosintética iniciada en el RER. Su función consiste en el transporte, maduración, acumulación y secreción de proteínas procedentes del retículo endoplásmico.
Lisosomas
Son vesículas que provienen del aparato de Golgi. Poseen membrana, y en su interior contienen enzimas hidrolasas ácidas que, para ser activas, necesitan un pH ácido mantenido gracias a una bomba de H+ que tiene en su membrana. La función de los lisosomas es digerir las sustancias que lleguen a su interior. Los lisosomas primarios son aquellos que sólo contienen las enzimas digestivas, mientras que los lisosomas secundarios, por haberse fundido con una vesícula con materia orgánica, contienen también sustratos en vía de digestión: vacuolas digestivas o heterofágicas, cuando el sustrato procede del exterior, y vacuolas autofágicas, cuando procede del interior.
Mitocondrias
Son los orgánulos polimorfos de las células eucariotas que se encargan de la obtención de energía. Su principal función es la respiración mitocondrial, proceso por el que el poder reductor producido en las reacciones de oxidación entra en la cadena transportadora de electrones y se obtiene energía en forma de ATP (proceso quimiosmótico) (ver t35).
Están formadas por:
La membrana externa, con gran número de proteínas transmembranales o porinas.
El espacio intermembranoso, de contenido similar al del citosol.
La membrana interna, con numerosas invaginaciones denominadas crestas. Contiene proteínas con tres funciones importantes para realizar la respiración mitocondrial: llevar a cabo reacciones de oxidación en la cadena respiratoria; sintetizar ATP mediante la enzima ATP-sintetasa (embebida en esta membrana) y permitir el paso selectivo de metabolitos mediante proteínas transportadoras.
La matriz, delimitada por la membrana interna. En ella se da un gran número de reacciones metabólicas de oxidación, como el ciclo de Krebs y la b-oxidación de los ácidos grasos. Además, contiene ribosomas, ADN mitocondrial, ARNt y las enzimas requeridas para la expresión de los genes mitocondriales.
Cloroplastos
Los cloroplastos son orgánulos típicos de las células vegetales, que poseen clorofila, y cuya función es realizar la fotosíntesis (ver t36) (transformación de la energía luminosa en energía química contenida en forma de ATP). Presentan doble membrana: una plastidial externa, y una plastidial interna. En el interior está el estroma. Inmerso en éste se encuentran los tilacoides o lamelas, que contienen los pigmentos fotosintéticos en su membrana (membrana tilacoidal).
FASE V: EVALUACIÓN.
1. Relacione las dos columnas:
1. Escriba al frente de cada organelo si pertenece a la célula vegetal, animal o ambos:
1. Complete
1.
Complete las siguientes frases:
TALLER DE PLAN LECTOR
JORNADA: MAÑANA
AÑO: 2.020 GRADO: SEXTO
AÑO: 2.020 GRADO: SEXTO
ELABORADO POR LA DOCENTE: POLICARPA MOYANO OTALORA.
NOMBRE DEL ESTUDIANTE: __________________ GRADO: ______
Apreciados estudiantes les envió un cordial saludo. La presente guía debe ser realizada en su totalidad y enviarla al siguiente correo: polita161972@gmail.com
1.Señala la respuesta correcta y completa.
1. 2. Ahora vamos a adivinar. Para ello, lee las adivinanzas. En el cuadro encontraras las respuestas. Debes colocar en cada adivinanza su respuesta correcta
A
EL SILENCIO
ABEJA
ESPEJO
ALMENDRO
ESTRELLA
AMAPOLA
RAZÓN
AMARILLO
HUEVO
ARAÑA
LA B
ÁRBOL
LA LENGUA
ARENA
PECES
BALÓN
RIO
CALLE
SOL
Ø Zumba que te zumbarás, van y vienen sin descanso, de flor en flor trajinando y nuestra vida endulzando.
Ø Yo fui tu primer sonido cuando comenzaste a hablar y soy la primera letra que en el alfabeto está.
Ø Son nuestras blancas flores a veces tan tempranas, que la nieve, envidiosa, viene a ver si nos gana.
Ø Unas manchas encarnadas entre los trigales; son notas coloreadas que alegran a zagales.
Ø Soy un color muy brillante que al azul no puedo ver, porque cuando estoy con él me pone verde al instante.
Ø Si la tengo, no te la doy, y si no la tengo te la doy.
Ø Si dices mi nombre se rompe.
Ø Una señora muy aseñorada nunca sale fuera y siempre esta mojada.
Ø Es alguien con el que pasas muchos ratos de tu vida, con el que juegas y corres y no le cuentas mentiras.
Ø Las apariencias engañan, eso hay que tenerlo en cuenta; pero si ves cuerda y caña. ¡Debajo esta una artimaña!
Ø En rincones y entre ramas mis redes voy construyendo, para que moscas incautas, en ellas vayan cayendo.
Ø Tiene yemas y no es huevo; tiene copa, no es sombrero; tiene hojas y no es libro; ¿Que es pues lo que os digo?
Ø Son mis colores tan brillantes que el cielo alegro en un instante.
Ø Lleva años en el mar y aún no sabe nadar.
Ø Corriendo entre los campos, cantando voy mi canción: a sedientos doy la vida antes de morirme yo.
Ø Todos pasean por mí, yo no paseo con nadie, todos preguntan por mi yo no pregunto por nadie.
Ø Muy bonito por delante, muy feo por detrás, me transformo a cada instante e imito a los demás.
Ø En un cuarto muy oscuro tengo un plato de avellanas que de día desaparecen y de noche se desparraman.
Ø De padres cantores provengo, pero no soy cantor, tengo el cuerpo blanco y amarillo el corazón.
Ø El burro la lleva a cuesta, escondida en un baúl, Yo no la tuve nunca, y siempre la tienes Tú.
1. Lee y completa
Lee los siguientes trabalenguas y represéntalo
Ø Uno cortito y muy fácil.
Pablito clavó un clavito. ¿Qué clavito clavó Pablito?
Ø La complicación está en la sílaba co.
Compadre, cómprame un coco.
Compadre, coco no compro porque el que poco coco come
poco coco compra. Yo, como poco coco como, poco coco compro.
Compadre, cómprame un coco. ¡Que no compro coco, ni como!
Compadre, coco no compro porque el que poco coco come
poco coco compra. Yo, como poco coco como, poco coco compro.
Compadre, cómprame un coco. ¡Que no compro coco, ni como!
Ø Un clásico sobre la r simple y doble.
El perro de San Roque no tiene rabo
porque Ramón Ramírez se lo ha cortado.
Y al perro de Ramón Ramírez ¿quién el rabo le ha cortado?
porque Ramón Ramírez se lo ha cortado.
Y al perro de Ramón Ramírez ¿quién el rabo le ha cortado?
Ø Uno de la r con la t.
Me trajo Tajo tres trajes, tres trajes me trajo Tajo.
Ø Otro tradicional para la r doble.
Erre con erre, guitarra;
erre con erre, carril:
rápido ruedan los carros,
rápido el ferrocarril.
erre con erre, carril:
rápido ruedan los carros,
rápido el ferrocarril.
Ø Otro clásico sobre la r simple en su versión más larga.
Tres tristes tigres comen trigo en un trigal.
Tanto trigo tragan
Tanto trigo tragan
que los tres tigres tragones
con el trigo se atragantan.
con el trigo se atragantan.
Ø Uno fácil con la ch.
Pancha plancha con cuatro planchas.
¿Con cuántas planchas plancha Pancha?
¿Con cuántas planchas plancha Pancha?
Ø Este es cortito sobre la p y las vocales i y a.
La madre y la hija van a misa.
La madre pisa paja y la hija paja pisa.
La madre pisa paja y la hija paja pisa.
Ø Uno de amor.
Cómo quieres que te quiera
si el que quiero no me quiera
no me quiere como quiero que me quiera.
si el que quiero no me quiera
no me quiere como quiero que me quiera.
Ø Para terminar, uno de mucha risa.
Los cojines de la reina,
los cajones del sultán.
¡Qué cojines!
¿Qué cajones!
¿En qué cajonera van?
los cajones del sultán.
¡Qué cojines!
¿Qué cajones!
¿En qué cajonera van?
4. Anagramas
Anagramas de letras: son los anagramas más comunes y se forman cuando se utilizan todas las letras de una palabra, pero invirtiendo el orden.
Por ejemplo: delira – lidera, Alegan – Ángela.
Analiza y escribe frente a cada palabra su anagrama
Alegan –
|
Riesgo –
|
Valora –
|
Agonista –
|
Colinas –
|
Calor –
|
Quieren –
|
Prisa –
|
Riesgo –
|
Poder –
|
Ramón –
|
Necrófila –
|
Poder –
|
Armonía –
|
Mora –
|
Salario –
|
Saunas –
|
Ovoide –
|
Aretes –
|
Camelia –
|
Ventilan –
|
Enlodar –
|
Trama –
|
Delira –
|
Cardiografía –
|
Agranda –
|
Desamparador –
|
Licúa –
|
Conservadora –
|
Amor –
|
Irónicamente –
|
Saco –
|
.
NOTA: recuerda leer la obra literaria acordada en clases.
GRADO SEXTO
ASIGNATURA DE QUÍMICA
PRIMER PERÍODO
PROFESORA: Mg. MAIRA ALEJANDRA BERMEO PARRA.
mairalejandra21@hotmail.com
UNIDAD 1: DESARROLLO HISTÓRICO DE LA QUÍMICA.
TEMAS:
1. Historia de la química.
2. Las cuatro épocas de la química.
3. Desarrollo de la teoría atómica.
4. Clasificación de la materia.
COMPETENCIAS A DESARROLLAR: Básicas, científicas, interpretativas, comprensión, argumentación y proposición.
ESTANDAR: •Me informo para participar en debates sobre temas de interés general en ciencias.
OBJETIVO: Conocer el desarrollo histórico de la química.
ESTUDIANTE: ______________________________________________________ COD: ______
FASE I: INDUCCIÓN AL TEMA.
LA GRAN AVENTURA HACIA EL DESCUBRIMIENTO DE LA QUIMICA.
Al principio se decía que la química estaba archivada en un gran libro, el cual se encontraba escondido dentro de la tumba de Aristóteles. Es decir que el mundo no conocía nada sobre la química.
Después de mucho tiempo 3 niños indígenas de la cultura azteca vieron lo mal que se encontraban sus familias, por causa de la llegada de los conquistadores, ya que les habían traído muchas epidemias y enfermedades. Así que estos 3 niños se pusieron a pensar que debería haber algo que les ayudara a encontrar remedio a esas enfermedades….
Una mañana, los 3 niños fueron a hablar con el jefe de su tribu, y este les dijo que fueran a Grecia y que debajo del instituto educativo más grande de Grecia se encontraba la tumba de Aristóteles quien tenía la solución, o un principio claro que iba a cambiar no solo la historia de los indígenas, sino también de la todo el mundo. Después de la charla que tuvieron con el jefe de la tribu, a estos 3 niños se les despertó un gran espíritu aventurero, así que a la mañana siguiente se subieron en una de las embarcaciones que se dirigían hacia Europa. Para el transcurso del viaje estos niños se llevaron consigo varias frutas, y también oro el cual iban a cambiar haya en Grecia por alimentos o simplemente para que no los maltrataran.
Al llegar a Grecia, barios filósofos y científicos griegos, les robaron todo su oro y los secuestraron para hacer experimentos con ellos, así que empezaron a maltratarlos y a interrogarlos, pero el ingenio de uno de los niños los salvo, ya que les dijo a los filósofos que había una fórmula para hacer más oro y que en su tribu lo llamaban el procedimiento de la alquimia, la cual consistía en que los metales de la tierra iban hacer cada vez más perfectos con el arte de la transmutación la cual supuestamente iba hacer que estos metales se convirtieran en oro. Afortunadamente los griegos se creyeron lo de la alquimia, y por lo tanto los soltaron, justo a tiempo para que siguieran su gran búsqueda, por otro lado los filósofos y científicos no consiguieron hacer oro, así que se sintieron engañados y muy felices. Ja, ja, ja, Se preguntaran porque felices?... claro es apenas obvio, porque aunque no consiguieron oro descubrieron muchísimas otras cosas, entre estos esta: la mejoración de la Fabricación de vidrio, alcohol, ácidos minerales: fósforo, ácido nítrico, agua regia (una mezcla de ácido nítrico y clorhídrico), ácido sulfúrico y ácido clorhídrico. Utilizando estos poderosos reactivos podían realizarse muchas reacciones nuevas. Como por ejemplo Los chinos descubrieron los nitratos y la pólvora, esto llego a occidente a través de los árabes. Y con transmutación y alquimia de algunos de estos minerales y metales se avanzó más en la química, por lo tanto empezaron a surgir los llamados químicos. Lo cual era raro, ya que estos tres niños sin darse cuenta estaban ayudando para el surgimiento de una gran ciencia la cual es importante ya que la mayoría de los cambios de la naturaleza, se lleva a cabo mediante cambios químicos como por ejemplo empezaron a surgir La producción de nuevos materiales, El diseño de nuevos procedimientos para controlar las enfermedades y La creación de nuevas fuentes de energía.
Gracias a la gran imaginación que surgió en un momento de desesperación en estos niños, dieron a conocer una ciencia y la solución a muchos faltantes, entre estos, la solución que ellos estaban buscando. Desafortunadamente los griegos no quedaron conformes y fueron en búsqueda de estos 3 pequeños indígenas.
Y peor a un era que estos pequeños estaban tan concentrados por lo que iban a buscar, que no se dieron cuenta que ya lo habían encontrado, sin necesidad de ir a buscar en una tumba.
Así que al llegar al instituto donde se encontraba la tumba de Aristóteles. Hicieron hasta lo imposible por abrir esa tumba pero estaba cubierta de muchas partículas de polvo, y para colmo de males los químicos Griegos los encontraron, pero para alivio de los indígenas esta vez los químicos no los maltrataron si no que al contrario les dieron a conocer todo lo que habían descubierto gracias a ellos, y también los querían recompensar de alguna forma, así que ellos pidieron que por favor les ayudaran a abrir la tumba. En esta gran aventura e intriga los químicos quedaron cubiertos de miles de partículas de polvo y el cielo se veía lleno de gases ya que también habían usado pólvora para ayudar a abrir la tumba.
Se preguntaran que tiene que ver las partículas de polvo y los gases, es sencillo, en ese mismo instante ocurrió algo extraordinario los químicos griegos descubrieron que uno de los principales estudios de la química era el estudio de los fenómenos de la naturaleza relacionados con la materia, sus cambios, su estructura, sus propiedades y su composición. Es decir que todo lo que existe en el universo está constituido por materia, pero más allá de eso descubrieron que los gases estaban compuestos por átomos de diferente naturaleza, lo cual su volumen era diferente, pero después otro químico dedujo que el volumen era igual en todas las naturalezas y que las partículas no solo eran átomos, si no grupos de átomos que formaban moléculas. Como se pueden imaginar ustedes, otra vez gracias a estos niños indígenas se descubrió otro avance en la química, por cierto muy importante y fundamental.
Regresando a lo de la tumba de Aristóteles, al ver dentro de ella, no se encontraba ninguna respuesta a lo que ellos buscaban, ya que en el interior de esta solo estaba un papel, el cual decía:
No es preciso escribir que hoy concluye los grandes avances y descubrimientos gracias a una ciencia llamada la química, sin embargo si les aseguro que van a tener muchas más aventuras…
FINNNNNNNNNNNNNNNNNN DEL CUENTO Y SIN UN FIN EXACTO DE LA QUIMICA…
LAURA GUECHA 8° A
ACTIVIDAD:
1. Hacer la lectura en mención, en voz baja.
2. Responder las siguientes preguntas en base a la lectura
A. ¿Qué otro título le colocarías a la lectura?
B. ¿Qué te gustó de la lectura y por qué?
C. ¿cuál fue la conclusión encontrada en la tumba de Aristóteles?
D. Escoge 5 palabras del texto leído e inventa una oración con cada una de ellas
E. Ocupando una página completa del cuaderno construye un dibujo alusivo en base a la lectura.
FASE II Y III: TEORÍA Y CONCEPTOS.
HISTORIA DE LA QUÍMICA
La historia de la química abarca un periodo de tiempo muy amplio, que va desde la prehistoria hasta el presente, y está ligada al desarrollo cultural de la humanidad y su conocimiento de la naturaleza. Las civilizaciones antiguas ya usaban tecnologías que demostraban su conocimiento de las transformaciones de la materia, y algunas servirían de base a los primeros estudios de la química. Entre ellas se cuentan la extracción de los metales de sus menas, la elaboración de aleaciones como el bronce, la fabricación de cerámica, esmaltes y vidrio, las fermentaciones de la cerveza y del vino, la extracción de sustancias de las plantas para usarlas como medicinas o perfumes y la transformación de las grasas en jabón.
Ni la filosofía ni la alquimia, la protociencia química, fueron capaces de explicar verazmente la naturaleza de la materia y sus transformaciones. Sin embargo, a base de realizar experimentos y registrar sus resultados los alquimistas establecieron los cimientos para la química moderna. El punto de inflexión hacia la química moderna se produjo en 1661 con la obra de Robert Boyle, The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes (El químico escéptico: o las dudas y paradojas quimio-físicas), donde se separa claramente la química de la alquimia, abogando por la introducción del método científico en los experimentos químicos. Se considera que la química alcanzó el rango de ciencia de pleno derecho con las investigaciones de Antoine Lavoisier, en las que basó su ley de conservación de la materia, entre otros descubrimientos que asentaron los pilares fundamentales de la química. A partir del siglo XVIII la química adquiere definitivamente las características de una ciencia experimental moderna. Se desarrollaron métodos de medición más precisos que permitieron un mejor conocimiento de los fenómenos y se desterraron creencias no demostradas.
La historia de la química se entrelaza con la historia de la física, como en la teoría atómica y en particular con la termodinámica, desde sus inicios con el propio Lavoisier, y especialmente a través de la obra de Willard Gibbs.
Antecedentes
El fuego fue la primera reacción química controlada por los humanos, aunque su naturaleza permaneció siendo un enigma durante milenios.
La primera reacción química de importancia que controlaron los humanos fue el fuego. Hay restos datados hace alrededor de 500 000 años que atestiguan el dominio del fuego, al menos desde los tiempos del Homo erectus. Este logro se considera una de las tecnologías más importantes de la historia. No solo proporcionaba calor y luz para alumbrarse, servía de protección contra los animales salvajes y después para despejar los bosques para cazar o cultivar, y además sería la base para el control de otras reacciones químicas, como las derivadas de la cocción de los alimentos (que facilitaron su digestión y disminuían la cantidad de microorganismos patógenos en ellos) y más tarde de tecnologías más complejas como la cerámica, la fabricación de ladrillos, la metalurgia, el vidrio o la destilación de perfumes, medicinas y otras sustancias contenidas en las plantas. Aunque el fuego fuera la primera reacción química usada de manera controlada, las culturas antiguas desconocían su etiología. Durante milenios se consideró una fuerza misteriosa y mística capaz de transformar unas sustancias en otras produciendo luz y calor. Al igual que se desconocían las causas del resto de transformaciones químicas, como las relacionadas con la metalurgia, aunque se dominaran sus técnicas.
Las primeras civilizaciones, como los egipcios y los babilónicos, concentraron un conocimiento práctico en lo que concierne a las artes relacionadas con la metalurgia, cerámica y tintes, sin embargo, no desarrollaron teorías complejas sobre sus observaciones.
Metalurgia
El primer metal empleado por los humanos fue el oro, que puede encontrarse en forma nativa, por lo que no necesitaba transformaciones químicas para su uso. La plata y el cobre también se pueden encontrar en forma nativa en pequeñas cantidades (además del estaño y el hierro meteórico que aparecen en cantidades exiguas) permitiendo un uso limitado de objetos metalísticos en las culturas antiguas.4 Las técnicas de esta metalurgia inicial se limitaban a fundir los metales con la ayuda del fuego para purificarlos y dar forma a los adornos o herramientas mediante moldes o cincelado. Pero los metales nativos son escasos, y hasta que se aprendió a extraer los metales a partir de sus minerales no se pudo generalizar el uso de los objetos metálicos, lo que sí implicó el control de reacciones químicas.
La cerámica y el vidrio
Además de la metalurgia el uso del fuego proporcionó a los humanos otras dos importantes tecnologías derivadas de transformaciones físico-químicas, la cerámica y el vidrio, cuyo desarrollo ha acompañado al hombre desde la prehistoria hasta el laboratorio moderno. Los orígenes de la cerámica datan del Neolítico cuando el hombre descubrió que los recipientes hechos de arcilla, cambiaban sus características mecánicas e incrementaban su resistencia frente al agua si eran calentados en el fuego. Para controlar mejor el proceso se desarrollaron diferentes tipos de hornos, y cada cultura desarrolló sus propias técnicas y formas.
En Egipto se descubrió que recubriendo la superficie con mezclas de determinados minerales (sobre todo mezclas basadas en el feldespato y la galena) la cerámica se cubría con una capa muy dura, menos porosa y brillante, el esmalte, cuyo color se podía cambiar añadiendo pequeñas cantidades de otros minerales o variando las condiciones de aireación del horno. Estas tecnologías se difundieron rápidamente. En China se perfeccionaron las tecnologías de fabricación de las cerámicas hasta dar con la porcelana en el siglo VII. Durante siglos China mantuvo el monopolio en la fabricación de la porcelana, y en Europa se desconocía como fabricarla hasta el siglo XVIII gracias a Johann Friedrich Böttger.
Relacionado con el desarrollo de la cerámica, aparece el desarrollo del vidrio a partir del cuarzo y carbonato de sodio o carbonato de potasio. Su desarrollo igualmente empezó en el Antiguo Egipto y fue perfeccionado por los romanos. Su producción masiva a finales del siglo XVIII instó al gobierno francés a premiar mediante concurso un nuevo método para la obtención del carbonato sódico ya que la fuente habitual (las cenizas de madera) no proporcionaba cantidades suficientes como para cubrir la creciente demanda. El ganador fue Nicolas Leblanc aunque su proceso cayó en desuso en favor del proceso de Solvay, desarrollado medio siglo más tarde, que impulsó enormemente el desarrollo de la industria química.
Transformaciones orgánicas de la Antigüedad
Las sociedades antiguas usaban un reducido número de transformaciones químicas naturales como las fermentaciones del vino, la cerveza o la leche. También conocían la transformación del alcohol en vinagre, que usaban como conservante y condimento. Las pieles se curtían y blanqueaban sumergiéndolas en orina añeja (cuya urea se transforma en amoniaco cuando se almacena largo tiempo) o soluciones de palomina (que contiene ácido úrico); y también se usaba su capacidad blanqueante con las manchas persistentes de los tejidos.18 Además tenían conocimiento del proceso de saponificación; los primeros registros de fabricación de jabones datan de Babilonia alrededor del 2800 a. C.19
Teorías filosóficas de la Antigüedad Clásica
Esquema con los cuatro elementos griegos clásicos:
Alchemy fire symbol.svg fuego • Alchemy earth symbol.svg tierra • Alchemy air symbol.svg aire • Alchemy water symbol.svg agua
en relación con sus propiedades y los demás elementos.
Los filósofos intentaron racionalizar por qué las diferentes sustancias tenían diferentes propiedades (color, dureza, olor...), estaban en diferentes estados (fluidos o sólidos) y reaccionaban de diferente manera ante los cambios del medio, por ejemplo frente al agua, el fuego o al ponerse en contacto con otras sustancias. Estas observaciones les impulsaron a postular las primeras teorías sobre la química y la naturaleza de la materia. Estas teorías filosóficas relativas a la química pueden encontrarse en todas las civilizaciones antiguas. Un aspecto común de todas ellas era el intento de encontrar un número reducido de elementos primarios que se combinarían entre sí para formar todas las demás sustancias de la naturaleza. Solían tratarse de sustancias conocidas como el agua, la tierra, la madera o el aire/viento, y formas de energía como el fuego o la luz, además de conceptos abstractos como el éter o el cielo. Varias civilizaciones diferentes coincidieron en muchos de estos conceptos, incluso entre culturas sin contacto, por ejemplo los filósofos griegos, indios, chinos y mayas consideraban que el agua, la tierra y el fuego eran elementos primarios, aunque cada una de estas culturas incluía uno o dos elementos diferentes más en su propio listado.
En la Grecia Clásica alrededor del 420 a. C. Empédocles afirmó que toda la materia estaba formada por cuatro sustancias elementales: tierra, fuego, aire y agua. En sintonía con esta creencia la escuela hipocrática sostenía que el cuerpo humano estaba formado por cuatro humores. Posteriormente Aristóteles añadió a los cuatro elementos clásicos el éter, la quintaesencia, razonando que el fuego, la tierra, el aire y el agua eran sustancias terrenales y corruptibles, y que como no se percibían cambios en las regiones celestiales, las estrellas y planetas no debían estar formados por ellos sino por una sustancia celestial e inmutable.20 En sus obras Física y Metafísica Aristóteles desarrolla sus conceptos duales de «sustancia y accidente», «esencia y forma», «acto y potencia» para explicar los cambios de la naturaleza, incluidas las transformaciones de la materia. Sus ideas sobre la composición y transformaciones de la materia, y el resto del funcionamiento de la naturaleza, se convirtieron el las predominantes tanto en Occidente como en Oriente Medio, influyendo en sus culturas durante dos milenios.
Demócrito fue el filósofo atomista griego más renombrado.
Primeros atomistas
Las teorías iniciales sobre el atomismo se remontan a la Antigua Grecia y la Antigua India.21 El atomismo griego se inició con los filósofos Leucipo de Mileto y su discípulo Demócrito alrededor del 380 a. C., que propusieron que la materia estaba compuesta por diminutas partículas indivisibles e indestructibles, denominadas por ello átomos (del griego ἄτομος «sin partes», «que no se dividen»). Afirmaciones similares fueron realizadas por el filósofo indio Kanada en sus textos de la escuela Vaisesika en un periodo cercano.21 También los jainistas de la época tenían creencias atomistas.21
Alrededor del 300 a. C. Epicuro postuló un universo formado por átomos indestructibles en el cual el hombre debía alcanzar el equilibrio. El filósofo Lucrecio trató de explicar la filosofía epicúrea al público romano en su obra del 50 a. C.,22 De rerum natura (Sobre la naturaleza de las cosas).23 En esta obra Lucrecio presenta los principios del atomismo, las teorías sobre la naturaleza de la mente y el alma, y explicaciones para los sentidos y el pensamiento, el desarrollo del mundo y los fenómenos naturales.
Al contrario del concepto moderno de atomicismo, esta teoría primitiva estaba enfocada más en la naturaleza filosófica de la naturaleza, con un interés menor por las observaciones empíricas y sin interés por los experimentos químicos.24
Tanto los atomistas griegos y romanos como los de la India carecían de datos empíricos que respaldaran sus creencias. Sin estas pruebas, a sus adversarios les resultó fácil negar sus tesis. En Occidente el atomismo nunca consiguió formar parte de la opinión mayoritaria de la época. Aristóteles se opuso a la existencia de los átomos en el 330 a. C. y su autoridad en el pensamiento occidental hizo que las ideas atomistas quedaran postergadas durante siglos, hasta bien entrada la Edad Moderna.
Alquimia
Emblema alquímico con los cuatro elementos clásicos además de los tria prima de Paracelso y los astros conocidos.
La alquimia (del árabe الخيمياء [al-khīmiyā]) es una antigua práctica protocientífica y una disciplina filosófica que combinaba elementos de la química, la metalurgia, la física y la medicina con la astrología, la semiología, el misticismo y el espiritualismo. La alquimia fue practicada en Mesopotamia, el Antiguo Egipto, Persia, la Antigua Grecia, el imperio romano, los califatos islámicos medievales y en la India, China y Europa hasta el siglo XVIII, por una compleja diversidad de escuelas y sistemas filosóficos que abarcaron al menos 2500 años.
La piedra filosofal y el esoterismo
La alquimia se define como la búsqueda hermética de la piedra filosofal (una sustancia legendaria capaz de transmutar los metales en oro o de otorgar la inmortalidad y la omnisciencia), cuyo estudio estaba impregnado de misticismo simbólico y era muy diferente de la ciencia moderna. Los alquimistas trabajaban para hacer transformaciones a nivel esotérico (espiritual) y exotérico (práctico).25 Estos aspectos exotéricos protocientíficos de la alquimia fueron los que contribuyeron a la evolución de la química en el Egipto greco-romano, la Edad de Oro del islam y después en Europa. La alquimia y la química comparten su interés por la composición y las propiedades de la materia, y con anterioridad al siglo XVIII no había distinción entre ambas disciplinas.
En el mundo helénico, la alquimia en principio proliferó en combinación con la magia y el ocultismo como una forma de estudio de las sustancias naturales para transmutarlas en oro y descubrir el elixir de la eterna juventud.27 La alquimia fue descubierta y practicada ampliamente en el mundo árabe después de la conquista de los musulmanes, y desde ahí, fue difuminándose hacia todo el mundo medieval y la Europa Renacentista a través de las traducciones latinas.28
Una de las principales aportaciones de la alquímica fue el desarrollo del instrumental de laboratorio. Imagen de la obra De distillatione (1608).
La alquimia aportó a la química la invención y desarrollo de gran parte del instrumental de laboratorio. Los primeros alquimistas occidentales, que vivieron en los primeros siglos de nuestra era, ya inventaron algunos equipamientos y procesos usados posteriormente por la química. El baño maría, o baño de agua para calentar controladamente, lleva el nombre de María la Judía considerada una de las fundadoras de la alquimia. En sus obras también aparecen las primeras descripciones del tribikos (un tipo de alambique de tres brazos) y del kerotakis (un dispositivo para recoger vapores). Cleopatra la Alquimista describió los métodos de fundición y destilación de la época, algunos le atribuyen la invención del primer alambique.30 Cuando la disciplina se desarrolló en el mundo islámico, la infraestructura experimental que estableció Jabir ibn Hayyan influiría en los procedimientos de los demás alquimistas islámicos, y posteriormente en Europa cuando se tradujeron al latín sus textos.
En su búsqueda de la piedra filosofal los alquimistas descubrieron y aprendieron a purificar muchas sustancias químicas como el alcohol, el amoníaco, la sosa cáustica, el vitriolo, el ácido muriático (clorhídrico), el ácido nítrico, el ácido cítrico, el ácido acético, el ácido fórmico, el arsénico, el antimonio, el bismuto y el fósforo, entre otras.
Elementos y metales de la alquimia
El sistema de elementos que usó la alquimia medieval fue desarrollado principalmente por el alquimista persa Jābir ibn Hayyān y se enraizaba en la tradición de los elementos griegos de la antigüedad clásica.31 Su sistema constaba de los cuatro elementos de Empédocles y Aristóteles: aire, tierra, fuego y agua a los que se añadían dos elementos filosóficos: el azufre, caracterizado por el principio de combustibilidad, «la piedra que arde»; y el mercurio que representaba las propiedades metálicas. Estos últimos eran considerados por los primeros alquimistas como expresiones idealizadas de los componentes irreductibles del universo,32 y fueron la principal contribución de la alquimia filosófica.
En la Edad Media en Occidente existía tradicionalmente una relación entre la alquimia y la astrología de estilo greco-babilónico. En esa época se conocían siete metales (que salvo el mercurio no se consideraban elementos) y también se conocían siete astros en torno a la Tierra (puesto que imperaba el geocentrismo), por lo que se relacionaba cada metal y sus propiedades con un astro.aLa identificación entre ambos llegaba hasta el punto de que el símbolo del planeta también se usaba para representar al metal. Las asociaciones eran las siguientes:
Sol Sun symbol.svg — oro;
Luna Crescent.svg — plata;
Mercurio Mercury symbol.svg — mercurio;
Venus Venus symbol.svg — cobre;
Marte Mars symbol.svg — hierro;
Júpiter Jupiter symbol.svg — estaño;
Saturno Saturn symbol.svg — plomo.b
En los últimos siglos de la edad media, en torno a 1250, Alberto Magno consiguió aislar el arsénico, aunque sus compuestos eran ya conocidos desde la antigüedad. Posteriormente el alquimista suizo Paracelso influido por la alquimia musulmana amplió también a siete los elementos en su lista alternativa, añadiendo a los cuatro tradicionales tres elementos alquímicos adicionales, denominados tría prima, tres principios metálicos para representar las propiedades de la materia: el azufre para la combustibilidad, el mercurio para la volatilidad y la estabilidad, y la sal para la solidez. Razonaba que los cuatro elementos de la teoría elemental aristotélica se manifestaban en los cuerpos como tres principios. Paracelso los consideraba principios fundamentales y los explicaba recurriendo al ejemplo de la madera ardiendo en el fuego. El mercurio que era el principio de la cohesión debía irse para que la madera se descompusiera, y como era volátil se desvanecía con el humo. El calor que se desprendía con las llamas provenía del azufre (la combustibilidad) y las cenizas que quedaban era la sal que implicaba la solidez.33
Jābir ibn Hayyān (Geber), alquimista persa que puso los cimientos de la química con sus experimentos.
Alquimia en el mundo islámico
En el mundo islámico se continuó la tradición clásica al traducirse al árabe las obras de los antiguos griegos y egipcios y fueron la cultura más próspera en todos los ámbitos científicos de la época.34 El desarrollo del método científico moderno fue lento y progresivo, y el principio del método científico en química comenzó entre los alquimistas musulmanes medievales, iniciado por el persa del siglo IX, Jābir ibn Hayyān (conocido como "Geber" en Europa), que se considera uno de los padres de la química.35363738 Él introdujo un enfoque sistemático y experimental a la investigación científica en el laboratorio, a diferencia de los antiguos griegos y egipcios cuyas obras se basaban en elucubraciones principalmente alegóricas y a veces ininteligibles.39c También inventó el alambique tal como lo conocemos y de él procede su nombre actual (al-anbiq), descubrió y analizó muchas sustancias químicas, estableció la distinción entre ácidos y álcalis, y fabricó cientos de medicinas.40 Además redefinió la teoría de los elementos clásicos, identificando también como elementos al mercurio y al azufre.41
Otros renombrados eruditos musulmanes de la época como Abū al-Rayhān al-Bīrūnī,42 Avicena43 y al-Kindi criticaron y rechazaron las teorías de la alquimia, particularmente la transmutación de los metales; y al-Tusi enunció una versión de la conservación de la masa, al afirmar que un cuerpo material podía cambiar pero no desaparecer.44 Al-Razi fue el primero en rechazar a la teoría aristotélica de los cuatro elementos clásicos y marcó el camino de la química usando el laboratorio en el sentido moderno, además de diseñar y describir más de veinte instrumentos, algunos de los cuales siguen usándose actualmente como el crisol o la retorta de destilación.
La alquimia del mundo islámico influyó posteriormente en Europa al ser traducidos al latín sus textos, sobre todo a partir del siglo XII, junto a los clásicos grecolatinos que habían desaparecido de Occidente. Por ejemplo Paracelso (1493-1541), reformó la teoría de los cuatro elementos siguiendo sus enseñanzas, y con solo un vago conocimiento de la química y la medicina oriental fundó un híbrido entre alquimia y ciencia al que denominó iatroquímica.
Problemas de la alquimia
Desde el punto de vista moderno, la alquimia presentaba varios problemas. En primer lugar su objetivo no era la ampliación del conocimiento de un modo racionalista como actualmente entendemos una ciencia, sino que su fin era encontrar materias míticas como la piedra filosofal, y los descubrimientos experimentales se producían de forma colateral. Además carecía de un sistema para nombrar los nuevos compuestos que se descubrían, y su lenguaje era esotérico y vago hasta el punto que sus términos significaban cosas diferentes para distintas personas. De hecho según The Fontana History of Chemistry (Brock, 1992):
El experimento del alquimista se incendia de Hendrick Heerschop (1626-1627).
El lenguaje de la alquimia pronto desarrolló un vocabulario técnico arcano y reservado diseñado para ocultar información a los no iniciados. En gran medida este lenguaje es incomprensible para nosotros hoy, aunque aparentemente los lectores del cuento del criado del canónigo de Geoffrey Chaucer y la audiencia de El alquimista de Ben Jonson eran capaces de interpretar lo suficiente como para reírse de ello.
El cuento «El criado del canónigo» de los Cuentos de Canterbury (de finales del siglo XIV) expone el lado más fraudulento de la alquimia, la pretensión de fabricar oro a partir de materias más baratas. También Dante Alighieri, un siglo antes, muestra su rechazo a este fraude al meter a todos los alquimistas en el infierno de su Divina Comedia.
La alquimia tampoco disponía de un método científico lógico y consensuado para hacer los experimentos reproducibles. De hecho muchos alquimistas incluían entre las anotaciones de sus métodos información irrelevante como los niveles de la marea o las fases de la Luna. La naturaleza esotérica y el vocabulario codificado de la alquimia al parecer servían sobre todo para ocultar que en realidad no tenían demasiadas certezas. Ya en el siglo XIV se evidenciaban las grietas en la fachada de la alquimia, y mucha gente se mostraba escéptica. Para haber avanzado habría necesitado un método normalizado que permitiera a otros reproducir los experimentos, y haberlos registrado de un modo claro que permitiera exponer lo que se sabía y lo que se desconocía.
En 1317, el papa Juan XXII de Aviñón ordenó la expulsión de todos los alquimistas de Francia por falsificar moneda. En 1403 se aprobó una ley en Inglaterra donde se penaba con la muerte la «multiplicación de metales». A pesar de todo la alquimia no desapareció, ya que parte de las clases privilegiadas y la realeza seguía creyendo que se podía descubrir la piedra filosofal y el elixir de la vida en su provecho.46 Durante el Renacimiento la alquimia exotérica siguió siendo popular en la forma de la iatroquímica de Paracelso, mientras que la alquimia espiritual también florecía fiel a sus raíces platónicas, herméticas y gnósticas. Así que la búsqueda de la piedra filosofal no fue abandonada a pesar de los escasos avances de la alquimia, y siguió siendo practicada por eruditos y médicos respetados hasta principios del siglo XVIII. Algunos practicantes de la alquimia de inicios de la era moderna actualmente son reconocidos por sus grandes contribuciones a la ciencia como Jan Baptist van Helmont, Robert Boyle e Isaac Newton.
Siglos XVII y XVIII: inicios de la química
Los intentos prácticos de mejorar el refinado de las menas minerales y la extracción de los metales a partir de ellas fue una importante fuente de información para los químicos del siglo XVI. Entre ellos destaca Georgius Agricola (1494-1555), que publicó la gran obra De re metallica (Sobre los metales) en 1556. En su obra se describen los procesos de la época en minería, extracción de los metales y metalurgia, ya muy complejos y desarrollados. Por ejemplo la obra describe la diversidad de tipos de altos hornos usados para la fundición de las menas minerales. Aborda el tema eliminando el misticismo que tenía asociado anteriormente, creando una base práctica que otros pudieran desarrollar, y estimuló el interés por los minerales y su composición. No es casual que mencione y use como referencia en numerosas ocasiones al autor de la antigüedad Plinio el Viejo y su obra Naturalis Historia. Se ha calificado a Agricola como el padre de la metalurgia.
En 1605, Francis Bacon publicó The Proficience and Advancement of Learning (La capacidad y progreso del aprendizaje), una obra científico-filosófica que contiene una descripción de cómo debería ser la práctica experimental que posteriormente se conocería como el método científico. En 1605 Michal Sedziwój publicó el tratado alquímico Novum Lumen Chymicum (La nueva luz de la química), que propone por primera vez la existencia en el aire de un «alimento para la vida», que posteriormente se reconocerá como el oxígeno (al principio aire desflogistizado). En 1615 Jean Beguin publicó Tyrocinium Chymicum (La práctica de la química), el primer libro de texto de química, donde aparece la primera ecuación química.49 En 1637 René Descartes publicó Discours de la méthode (El discurso del método), un ensayo que basa la investigación científica en los cálculos matemáticos y la desconfianza en los hechos no probados.
La obra del químico holandés Jan Baptist van Helmont, Ortus medicinae (El origen de la medicina) publicada póstumamente en 1648, se considera la principal obra de transición entre la alquimia y la química, e influyó notablemente en Robert Boyle. El libro contiene el resultado de numerosos experimentos y enuncia una versión inicial de la ley de conservación de la masa. Baptist van Helmont, que trabajó en el periodo inmediatamente posterior a Paracelso y su iatroquímica, indicó que existían otras materias «insustanciales» además del aire, y acuñó para ellas el nombre de «gas» (del griego cáos). Además de por la introducción de la palabra gas en el vocabulario científico y ser el fundador de la química neumática, experimentando con reacciones entre gases, Jan Baptist van Helmont también es recordado actualmente por sus ideas sobre la generación espontánea.
En 1669 el alquimista alemán Hennig Brandt descubrió el fósforo a partir de la orina.50 Para lograrlo destiló una mezcla de orina y arena (50 cubos). Al evaporar la urea obtuvo un material blanco que brillaba en la oscuridad y ardía con una llama brillante.
Robert Boyle, uno de los cofundadores de la química moderna por mejorar los métodos experimentales que separarían la química de la alquimia.
Robert Boyle
Se considera que el químico inglés Robert Boyle (1627-1691) apartó definitivamente a la química de la alquimia al mejorar su método experimental.51 Aunque su investigación tiene sus raíces claramente en la tradición alquímica, actualmente se reconoce a Boyle como el primer químico moderno, y por ello uno de los fundadores de la química moderna, y uno de los pioneros del método científico experimental moderno. Se le conoce principalmente por la ley de Boyle que presentó en 1662,52 aunque Boyle no fue su descubridor original. La ley describe la relación inversamente proporcional que existe entre la presión y el volumen de un gas, si se mantiene constante la temperatura en un sistema cerrado.
Se reconoce como un hito científico la publicación de la obra de Boyle The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes (El químico escéptico: o las dudas y paradojas quimio-físicas) en 1661, que se considera un pilar fundamental del campo de la química. En la obra Boyle presenta su hipótesis de que todos los fenómenos son el resultado de la colisión de las partículas en movimiento. Boyle apela a los químicos para que experimenten y afirma que los experimentos contradicen que los elementos químicos se limiten a los cuatro elementos clásicos. También declaró que la química debería dejar de estar subordinada a la medicina o la alquimia, y debería alzarse al estatus de ciencia por sí misma. Destaca su defensa de la experimentación científica rigurosa. Boyle creía que todas las teorías deberían probarse experimentalmente antes de ser consideradas ciertas. Su obra además contiene algunas de las primeras ideas modernas sobre átomos, moléculas y reacciones químicas, por lo que marcó el inicio de la historia de la química moderna.
Boyle también trató de purificar las sustancias químicas para obtener reacciones reproducibles. Fue un defensor de la filosofía mecánica propuesta por René Descartes para explicar y cuantificar las propiedades e interacciones de las sustancias químicas. Boyle era un atomista, pero prefería la palabra corpúsculo a átomo. Puntualizó que la división más pequeña de la materia a la que se mantenían las propiedades era a nivel de los corpúsculos. Además realizó numerosas investigaciones con una bomba de aire. Observó que al sacar el aire las llamas se extinguían y se morían los animales situados dentro, y también hacía descender los niveles del barómetro. Boyle repitió los tres experimentos de van Helmont, y fue el primero en usar indicadores que cambiaran de color con la acidez. Por todo ello Boyle ayudó a asentar los pilares de la revolución química con su filosofía corpuscular mecánica.
Teoría del flogisto
Joseph Priestley, codescubridor del oxígeno, al que denominó «aire desflogistizado»
A finales del siglo XVII y principios de XVIII se propuso la teoría del flogisto para intentar explicar los procesos de combustión y oxido-reducción mediante la pérdida o transferencia, respectivamente, de un supuesto fluido denominado flogisto.56 La teoría fue propuesta inicialmente por Johann Becher y desarrollada por Georg Stahl, ambos químicos alemanes. Becher postuló otra reforma de la teoría de los cuatro elementos en la que solo la tierra y el agua serían componentes de las materias, en distintas proporciones, y el fuego y el aire serían meramente agentes de las transformaciones. A su vez existirían tres tipos distintos de tierras, cada una de ellas portadora de una propiedad: el aspecto vítreo, la fluidez o volatilidad, y el carácter inflamable. Para esta última Georg Stahl acuño el término flogisto en 1702. Toda sustancia susceptible de sufrir combustión contendría cierta cantidad de flogisto, y el proceso de combustión consistiría básicamente en la pérdida de dicha sustancia.
Se conocía desde la antigüedad que algunas sales metálicas podían ser transformadas de nuevo en los metales de partida. Stahl explicó este proceso suponiendo que los metales estaban formados por una cal y un principio inflamable carente de masa, el flogisto, por lo que la calcinación, es decir, la formación de la cal, se podía explicar, al igual que la combustión, como un desprendimiento de flogisto, el cual se liberaba del metal y dejaba la cal al descubierto en las cenizas. El proceso inverso, la reducción de la cal al metal, podía ser igualmente explicado como una adición de flogisto. Si una sustancia rica en flogisto, como el carbón, era puesta en contacto con una cal metálica, podía transferirle su flogisto y dar lugar a la formación del metal.
Joseph Priestley usó la teoría del flogisto en sus experimentos de química pneumática para explicar las transformaciones de los gases. Priestley denominó al residuo de aire que quedaba tras un proceso de combustión «aire flogistizado» (en realidad, una mezcla de nitrógeno y dióxido de carbono), pues pensaba que durante la combustión dicho aire había absorbido todo el flogisto que tenía capacidad de albergar, y por eso cesaba la combustión. Siguiendo esta línea de razonamiento, cuando Priestley calentó la cal roja de mercurio y recogió un tipo de aire que podía mantener más tiempo la combustión lo denominó «aire desflogistizado». Posteriormente Lavoisier lo llamaría oxígeno.
La teoría del flogisto fue popular durante el siglo XVIII hasta que Antoine Lavoisier la refutó en su obra Réflexions sur le phlogistique, pour servir de suite à la théorie de la combustion et de la calcination (Reflexiones sobre el flogisto, para formar parte de la teoría de la combustión y la calcinación) publicada en 1777. Según Stahl cualquier sólido liberaba flogisto bajo la acción del fuego, luego tras la combustión perdería masa o la mantendría (según el flogisto tuviera masa o no). Sin embargo, Lavoisier hizo experimentos calcinando metales y después de la calcinación en algunos el peso del residuo (los óxidos) era mayor que el cuerpo inicial. En estos casos el flogisto tendría un peso negativo, lo que resultaba absurdo, y demostraba la inconsistencia de la teoría del flogisto.
Descubrimientos del siglo XVIII
Tabla de afinidades, de E. F. Geoffroy (1718). En la cabecera de cada columna una sustancia seguida de todas con las que se puede combinar.
En el siglo XVIII se multiplicaron los descubrimientos de nuevos elementos, gracias al cambio en los métodos de investigación. Un hecho sin precedentes desde la antigüedad, ya que en los dos milenios anteriores se habían descubierto solo cinco (arsénico, antimonio, zinc,bismuto y fósforo). Alrededor de 1735 el químico sueco Georg Brandt analizó un pigmento azul oscuro encontrado en la mena del cobre descubriendo lo que posteriormente conoceríamos como cobalto. En 1748 el español Antonio de Ulloa publicó la descripción de un nuevo metal, el platino.59 En 1751 un discípulo de Stahl, Axel Fredrik Cronstedt, identificó en una impureza del mineral del cobre otro nuevo metal, el níquel. A Cronstedt se le considera uno de los fundadores de la mineralogía moderna.60 En 1766 el químico inglés Henry Cavendish aisló el hidrógeno, al que llamó «aire inflamable». En 1773 el sueco Carl Wilhelm Scheele descubrió el oxígeno, al que llamó «aire de fuego»,61 aunque al no publicar inmediatamente su hallazgo dio tiempo a Joseph Priestley a publicarlo 1774, tras haber descubierto el mismo gas independientemente al cual llamó «aire deflogistizado».62 En 1783 los hermanos españoles Juan José y Fausto Elhuyar consiguieron aislar el wolframio a partir del mineral wolframita.
En el siglo también se descubrieron destacados compuestos. En 1754 el escocés Joseph Black aisló el dióxido de carbono, al que llamó «aire invariable».65 En 1757 el francés Louis Claude Cadet de Gassicourt, mientras investigaba los compuestos del arsénico creó el líquido fumante de Cadet, que posteriormente se sabría que contenía óxido de cacodilo, y por ello es considerado el primer compuesto organometálico que se logró sintetizar.66 Y además en 1758 Joseph Black formuló el concepto de calor latente para explicar los cambio de estado.67
Antoine Lavoisier
El primer calorímetro usado por Antoine Lavoisier y Pierre-Simon Laplace, para determinar el calor relativo a los cambios químicos, cálculos en los que se basó Joseph Black para descubrir el calor latente. Estos experimentos marcaron el inicio de la termoquímica.
Aunque la investigación química se puede remontar a la antigua Babilonia, Egipto, y especialmente a Persia y Arabia de la Edad de Oro del islam, la química floreció a partir de la época de Antoine Lavoisier, un químico francés reconocido como el «padre de la química moderna». En 1789 Lavoisier estableció formalmente la ley de conservación de la materia, que en su honor también se conoce como «Ley Lomonósov-Lavoisier».68 Para demostrarla realizó múltiples experimentos. Demostró con medidas meticulosas que las transmutaciones no eran posibles, por ejemplo, no se transformaba el agua en tierra, sino que el sedimento que se observa al hervir agua procedía del contenedor; o que al quemar al aire fósforo y azufre, probó que aunque los productos pesaban más, el peso ganado procedía del aire.
Antoine Lavoisier (1743-1794).
Repitiendo los experimentos de Priestley demostró que el aire estaba compuesto de dos partes (no era un elemento), y una de ellas se combinaba con los metales para formar las cales. En Considérations Générales sur la Nature des Acides (1778) demostró que la parte del aire responsable de la combustión también era la fuente de la acidez en disoluciones. Al año siguiente nombró a esta parte oxígeno (del griego formador de ácidos), y a la otra azote (sin vida). Por ello se considera a Lavoisier el descubridor del oxígeno junto a Preistley y Scheele. También observó que el «aire inflamable» descubierto por Cavendish al combinarlo con oxígeno producía una condensación, como informó Priestley, que parecía ser agua (luego tampoco el agua era un elemento), por ello denominó a este gas hidrógeno (del griego «formador de agua»).
Como se indicó en el apartado anterior, en Reflexions sur le Phlogistique (1783) Lavoisier refutó la teoría del flogisto para la combustión. En Rusia Mikhail Lomonosov independientemente llegó a conclusiones similares sobre la conservación de la materia y el flogisto. Además Lomonosov anticipó la teoría cinética de los gases, al considerar que el calor provenía de una forma de movimiento.
Lavoisier trabajó con Claude Louis Berthollet y otros para idear un sistema de nomenclatura química que fue la base del sistema moderno de nombrar compuestos químicos. En su Methods of Chemical Nomenclature (1787), Lavoisier inventó la forma de nombrar y clasificar compuestos que se usa principalmente en la actualidad, que incluye nombres como ácido sulfúrico, sulfatos y sulfitos. En 1785 Berthollet determinó la composición elemental del amoniaco. Ese mismo año Berthollet fue el primero en usar el gas cloro como blanqueante comercial, y en 1789 fue el primero en fabricar lejía al burbujear gas a través de una solución de carbonato de sodio, consiguiendo una solución de hipoclorito sódico. También estudió y fue el primero en producir otro fuerte oxidante y blanqueante de cloro, el clorato de potasio (KClO3), conocido como sal de Berthollet. Berthollet también es conocido por sus contribuciones a la teoría del equilibrio químico a través del mecanismo de reacción reversible.
La obra de Lavoisier Traité Élémentaire de Chimie (Tratado elemental de química, 1789) fue el primer libro de texto de la química moderna, y presentaba un punto de vista unificado de las nuevas teorías químicas, contenía una declaración clara de la ley de conservación de la masa, y negaba la existencia del flogisto. Además presentaba una lista de elementos, o sustancias que no podían descomponerse, que incluía al oxígeno, el nitrógeno, el hidrógeno, el fósforo, el mercurio, el zinc y el azufre. Sin embargo, en su lista también se incluía la luz y el calórico, que él creía que eran sustancias materiales. En la obra Lavoisier remarcó que la observación era la base de su química, afirmando que:
He intentado (...) llegar a la verdad reuniendo hechos, para suprimir en lo posible el razonamiento, que a menudo es el responsable de engañarnos, para seguir en lo posible la luz de la observación y del experimento.
Lavoisier demostró que los organismos vivos descomponían y recomponían el aire atmosférico de la misma forma que lo hacía una llama. Junto a Pierre-Simon Laplace, Lavoisier usó un calorímetro para estimar el calor por unidad de dióxido de carbono producido en una combustión. Y descubrió unas medias similares para las llamas y los animales, lo que indicaba que los animales producían energía por medio de un tipo de combustión. Además descubrió que el diamante era una forma cristalina del carbón.
Sin embargo como es lógico, en su obra no todo fueron aciertos. Lavoisier no creía en el atomismo y pensaba que la existencia real de los átomos era filosóficamente imposible. Lavoisier creía en la teoría de los radicales y pensaba que los radicales funcionaban como un solo grupo que se combinaría con el oxígeno en las reacciones. Creía que todos los ácidos contenían oxígeno. A pesar de ello, la labor de Lavoisier fue fundamental para la ciencia química. Al impulso que se produjo en la investigación basada en su ley de conservación de la masa, su teoría sobre la combustión mediante el oxígeno, además de la teoría corpuscular mecánica, se conoce como revolución química. Tras su obra la química adquirió una naturaleza estrictamente cuantitativa, lo que permitiría hacer predicciones fiables. Su contribución a la revolución química fue el resultado principalmente de su esfuerzo consciente de encajar todos sus experimentos en el marco de una sola teoría. Estableció de forma consistente el uso del equilibrio químico, usó el descubrimiento del oxígeno para refutar la teoría del flojisto y desarrolló un nuevo sistema de nomenclatura química. Lamentablemente su brillantez y autoridad científica no evitaron que Lavoisier fuera decapitado durante la Revolución francesa.
El físico italiano Alessandro Volta fue uno de los pioneros en los estudios sobre la electricidad. En 1775 Volta perfeccionó y popularizó el electróforo, un dispositivo con dos discos metálicos separados por un conductor húmedo, pero unidos con un circuito exterior, capaz de producir electricidad estática. En 1794 Volta revisó los estudios sobre la «electricidad animal». En 1780 Luigi Galvani había observado que al poner en contacto dos metales diferentes con el músculo de una rana se originaba la aparición de corriente eléctrica. A Volta le interesó la idea y comenzó a experimentar con metales únicamente, y llegó a la conclusión de que el tejido muscular animal no era necesario para producir la corriente eléctrica. Este hallazgo suscitó una fuerte controversia entre los partidarios de la electricidad animal y los defensores de la electricidad metálica, pero la demostración, realizada en 1800, del funcionamiento de la primera pila eléctrica certificó la victoria del bando favorable a las tesis de Volta.
Su pila voltaica de 1800 consistía en un apilamiento de varios pares de discos de cobre y zinc alternados (electrodos) separados por una capa de tela o cartón empapada en salmuera (electrolito) para incrementar la conductividad.70 Cuando se conectaba la parte superior y la inferior con un cable separados, y perdía poca carga con el tiempo cuando no se la utiliza, con lo que Volta consiguió la primera batería eléctrica para producir electricidad. Por ello se considera a Volta el fundador de la electroquímica.71 A partir de entonces se usarán las pilas voltaicas (o galvánicas) en el estudio las reacciones redox y sus productos. Además Alessandro Volta entre 1776 y 1778 se dedicó al estudio de la química de los gases y fue el descubridor del metano.
FASE IV: TALLER DE REPASO.
OBSERVAR EL VIDEO SOBRE HISTORIA DE LA QUÍMICA QUE SE ENCUENTRA EN LA SIGUIENTE PÁGINA
WEB: http://www.slideshare.net/majosilva/ppt-origen-e-historia-de-la-qumica
Y RESOLVER EL SIGUIENTE TALLER:
1. Cuáles son los períodos en los que se encuentra dividida la historia de la química.
2. Nombra tres acontecimientos del período prehistórico de la química.
3. Nombra tres acontecimientos del período de la antigüedad de la química.
4. Cuáles fueron los principales aportes de los griegos a la química.
5. Nombra 6 personajes que hayan intervenido en el período griego de la química.
6. En qué consiste la hipótesis atómica, dada en el período griego de la química.
7. Nombra 6 personajes que hayan intervenido en el período de la alquimia
9. Según los alquimistas cuál era su principal misión en la tierra.
10. Cuál fue el principal expositor de la iatroquímica.
11. Cuáles fueron los principales aportes del período de la iatroquímica.
12. En qué consistió el flogisto.
13. Nombra dos personajes que estén relacionados con el flogisto.
14. Quién es el principal expositor del período moderno de la química.
15. Nombre los principales aportes del período moderno de la química.
16. Nombra los principales premios nobel de química.
17. Elabora un mapa conceptual sobre la historia de la química.
FASE V: EVALUACIÓN.
Realiza las siguientes actividades en una hoja cuadriculada grande marcada con tu nombre:
1. Elabora un mapa conceptual en donde se muestren en orden cronológico los antecedentes y los principales aportes en el desarrollo de la química.
2. Responde: ¿Cuáles de los métodos importantes que surgieron a partir de la alquimia, se aplican en la vida de las personas?
Responde: ¿cuáles son los principales retos para la química en esta época?
BIOLOGIA GRADO SEXTO
AREA INGLES
LUZ MARINA ARIAS
NOTA: DEVOLVER SOLUCION DEL TALLER AL CORREO
luzmarinarias@gmail.com jornada tarde
LUZ MARINA ARIAS
NOTA: DEVOLVER SOLUCION DEL TALLER AL CORREO
luzmarinarias@gmail.com jornada tarde
enviar trabajos de matematicas a este correo profesor victor gutierrez jornada mañana
estudiandoconvictor2020@hotmail.com
enviar trabajos de geometria y estadistica a este correo
jornada tarde o mañana segun el caso
estudiandoconvictor2020@hotmail.com prof. victor
sextorodrigo1@gmail.com prof.Rodrigo
area de sociales
enviar taller a este correo Jornada tarde

JORNADA: MAÑANA AÑO: 2.020 GRADO: SEXTO
TALLER DE TECNOLOGÍA E INFORMÁTICA
ELABORADO POR LA DOCENTE: POLICARPA MOYANO OTALORA.
NOMBRE DEL ESTUDIANTE: ___________________________ GRADO: ______
1. Desarrollar los siguientes ejercicios basados en Paint.
PAINT
a. Dibuja el icono de Paint.
b. Escriba el nombre de los bloques de trabajo de la pestaña inicio.
c. Dibuja los iconos del bloque herramientas: escribe su función.
d. Escribir las formas de pinceles que tiene en el bloque de pinceles.
e. Une cada función con su botón correspondiente
LAPIZ
· Sirve para suprimir partes del dibujo que no
desea tenerlo.
BORRADOR · Permite dibujar en la imagen.
PIINCEL
· Dibuja líneas y pinta de la forma y tamaños seleccionado.
· Sirve para hacer líneas rectas con el tamaño deseado.
LINEA
1. Consulta y responde las siguientes preguntas.
Hardware – Software
a. ¿Cuál es la diferencia entre el Hardware y el Software?
b. ¿En cuál componente del computador se guarda la información de manera permanente?
c. ¿Cuáles son los dispositivos de ENTRADA de un computador?
d. ¿Cuáles son los dispositivos de SALIDA de un computador?
e. ¿Cómo podemos definir el procesador?
f. ¿Cuál es la parte fundamental del software?
2. Teniendo en cuenta que todos los derechos se basan en la igual, desarrolle la siguiente sopa de letras.
INSTITUCION EDUCATIVA ANGEL MARIA PAREDES
AREA LENGUA CASTELLANA Y PLAN LECTOR
GRADO SEXTO – JORNADA TARDE y MAÑAMA
DOCENTE SANDRA GUTIERREZ
NOTA: Desarrolla los siguientes ejercicios en hojas y envíalos al correo Sandra.gutierrez.edu@gmail.com PROF. SANDRA
amerikalvarado@gmail.com PROF.AMERICA
NOTA: Desarrolla los siguientes ejercicios en hojas y envíalos al correo Sandra.gutierrez.edu@gmail.com PROF. SANDRA
amerikalvarado@gmail.com PROF.AMERICA
Vamos a afianzar desde casa lo trabajado en
clase.
Recordemos:
LOS ELEMENTOS DE LA COMUNICACIÓN
Ahora recordemos
Teniendo en cuenta esta información completa el
siguiente ejercicio
EL TEXTO DESCRIPTIVO
Ahora describe un animal que te guste y realiza
su dibujo
Capítulo 1
Platero es pequeño, peludo, suave; tan blando
por fuera, que se diría todo de algodón, que no lleva huesos. Sólo los espejos
de azabache de sus ojos son duros cual dos escarabajos de cristal negro.
Lo dejo suelto y se va al prado, y
acaricia tibiamente con su hocico, rozándolas apenas, las florecillas rosas,
celestes y gualdas... Lo llamo dulcemente: "¿Platero?", y viene
a mí con un trotecillo alegre que parece que se ríe en no sé qué cascabeleo ideal...
Come cuanto le doy. Le gustan las naranjas
mandarinas, las uvas moscateles, todas de ámbar; los higos morados, con su
cristalina gotita de miel...
Es tierno y mimoso igual que un niño, que una
niña...; pero fuerte y seco por dentro como de piedra. Cuando paso sobre él,
los domingos, por las últimas callejas del pueblo, los hombres del campo,
vestidos de limpio y despaciosos, se quedan mirándolo:
—Tien’ asero...
Tiene acero. Acero y plata de luna, al mismo tiempo.
ACTIVIDADES
1.- Consultando el
diccionario, escribe el significado de las siguientes
palabras:
Alforja:
Arroyo:
Azabache:
Azadones:
Azotea:
Marchitar:
Mustia:
Púa:
Vid:
2.- Relaciona, con una flecha, cada animal con su sonido:
Asno
Cantar
Grillo
Trinar
Perra
Rebuznar
Pájaros
Aullar
Patos
Silbar
3.- En el primer capítulo del libro, Juan Ramón nos describe a Platero.
Responde
a las siguientes preguntas:
¿Qué animal es?
¿Qué sonido emite ese animal?
¿Qué aspecto físico tiene Platero?
¿Qué adjetivos utiliza para describirlo por fuera?
¿Cuál es su carácter?
¿Con qué se compara su pelo, sus ojos y su fortaleza
¿Qué aspecto físico tiene Platero?
¿Qué adjetivos utiliza para describirlo por fuera?
¿Cuál es su carácter?
¿Con qué se compara su pelo, sus ojos y su fortaleza
¿Por qué crees
que le llama Platero?
¿Qué sentimientos te inspira el borriquillo de Juan Ramón?
¿Qué sentimientos te inspira el borriquillo de Juan Ramón?
¿Qué
piensan de Platero los hombres del campo?
ARITMÉTICA SEXTO GRADO
TALLER SOBRE CONJUNTOS.
NOTA: Desarrolla los siguientes ejercicios
en hojas y envíalos al correo sanpigu@hotmail.com
1. ¿Cuáles de los siguientes conjuntos son vacíos,
unitarios, finitos, infinitos?
a. A = { x I x es día de la semana}
b. B = { vocales de la palabra conjunto}
c. C = {
1, 3, 5, 7, 9, }
d. D = {x I x es un número par}
e. E = {x I x < 15}
f. F = {x I es la solución de y(x)=IxI }
2. ¿Cuál es conjunto formado por la intersección de
los conjuntos {e, x, i, t, o} y {t, r, i, u, n, f, o}?
3. Representa la unión de los conjuntos {e, x, i, t,
o} y {t, r, i, u, n, f, o}
4. Cuál es la intersección de los siguientes
conjuntos: A= {l, u, n, a} y B= {t, r, i, u, n, f, o}
5. Obtener la diferencia A-B si A= {c, o, r, a, z,
n} y B={h, i, p, e, r, t, n, s, o}
6. Dado los conjuntos: 𝑈 = {1,2,3,4,5,6,7,8,9};
𝑨 = {𝟏, 𝟒, 𝟔, 𝟗}; 𝑩 = {𝟐,
𝟑, 𝟒, 𝟓, 𝟖}; 𝑪 = {𝟏, 𝟐,
𝟓, 𝟔, 𝟕}, desarrollar analítica y
gráficamente las operaciones entre conjuntos solicitadas.
a. 𝑨 ∪ 𝑩
𝒃. 𝑪 ∩ 𝑨
𝒄. 𝑩 − 𝑨
𝒅.
𝑨 – 𝑪
+6
7.Identifica
la operación dada rayando o sombreando el conjunto que represente acorde con
las figuras dadas a continuación.
8.
Construye la
gráfica para las operaciones indicadas dado los siguientes conjuntos:
∪= {𝟏,
𝟐, 𝟑, 𝟒, 𝟓, 𝟔, 𝟕, 𝟖, 𝟗,
𝟏𝟎}; 𝑨 = {𝟏, 𝟑, 𝟒, 𝟓, 𝟔};
𝑩 = {𝟐, 𝟒, 𝟔, 𝟕, 𝟖} 𝑪 =
{𝟏, 𝟐, 𝟑, 𝟔, 𝟖, 𝟗}, se pide:
𝒂.
𝑨 ∩ 𝑪
𝒃.
𝑪 − 𝑩
𝒄.
(𝑨 ∪ 𝑩)
𝒅.
(𝑩 − 𝑨)
𝒆.
(𝑨 ∪ 𝑪)
9.
Sean los conjuntos 𝑈 = {𝑎; 𝑏; 𝑐; 𝑑; 𝑒;
𝑓 ; 𝑔; ℎ; 𝑖}, 𝐴 = {𝑎; 𝑐; 𝑔},
𝐵 = {𝑏; 𝑑; 𝑓 }, 𝐶 = {𝑎; 𝑏;
𝑒; 𝑔; 𝑖}
𝒂. 𝑨 ∪ 𝑪
𝒃. 𝑩 − 𝑪
𝒄. 𝑪 − 𝑨
𝒅.
𝑨 ∩ 𝑪
𝒆. 𝑪 − 𝑩
10. Expresa por extensión y comprensión los siguientes conjuntos:
a. El conjunto A,
formado por los colores primarios.
b. El conjunto B
formado por los números del 1 al 10.
c.
El conjunto M formado por los meses del año.
d. El conjunto E
formado por los países que estarán en el mundial de futbol 2022.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
GRADO SEXTO
ASIGNATURA DE BIOLOGÍA
PRIMER PERÍODO
PROFESORA: LIC: NOHORA NARNHAEZ L
enviar al correo: minstitucion701@gmail.com
UNIDAD: ámbito celular
TEMA: clasificación de los seres vivos.
ESTANDAR: Reconozco los avances científicos y su aplicación en la teoría celular y clasificación
de los seres vivos.
de los seres vivos.
ESTUDIANTE: _________________________________________________ GRADO:______
CONSULTA EL TEMA PARA QUE PUEDA RESPONDER LAS SIGUIENTES PREGUNTAS
PARA QUE REALICE UN TRABAJO ESCRITO
PARA QUE REALICE UN TRABAJO ESCRITO
TALLER: CLASIFICACIÓN DE LOS SERES VIVOS
- Consulta en el diccionario la palabra colonizar. Crea un acróstico con ella.
- Consulta cinco ejemplos de bacterias con su respectivo dibujo
- Entre las algas azul – verdosas y una planta común y corriente. ¿qué diferencias hay? ¿Cuáles semejanzas podrías notar?
- Describe las características del reino protista y cita tres ejemplos con su dibujo.
- ¿Cuál es la razón por la que los hongos no están clasificados en el reino vegetal?
- Consulta en el diccionario el significado de las palabras hifas y espora. Escribe una oración con ellas.
- Se dice que los hongos son organismos más complejos que los protistos. Escribe la razón de esta afirmación.
- Escribe los principales grupos de hongos que existen y define el método de clasificación de cada uno de ellos.
- Escribe dos características comunes a todos los animales.
- Escribe una lista de 20 animales que conoces e intenta clasificarlos.
- Consulta en el diccionario el significado de la palabra vascular.
- ¿Cuáles son los grupos de plantas que hay y cuáles son sus características?
- Realiza un cuadro sinóptico con los cinco reinos de la naturaleza. Resume las principales propiedades de cada reino. Dibuja uno o dos organismos de cada categoría.












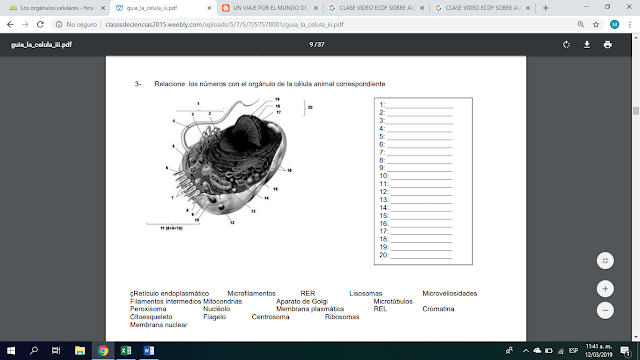





































buenas noches soy mama de un niño de 6 mi pregunta es todo debe desarrollarse antes que termine el periodo??? que fecha es limite para entregar los trabajos?? y los niños que no tienen computador e internet que van a hacer??
ResponderBorrarLos tranbajos hay q entregarlos el 20 de este mes
BorrarEstos trabajos no me gustaron para nada
BorrarMuy Buenas noches!!! Queridos Docentes y administrativos, soy la mamita de un niño de sexto grado jornada mañana. Queria pedirlas un grande favor, que posibilidad existe de poder adquirir el número telefónico o correo de la o el docente encargado del grupo. Les agradezco, tengo unas inquietudes y me es urgente poderme contactar. Agradezco la atención prestada, quedare atenta para cualquier información. Dios los Bendiga
ResponderBorrarlos trabajos los realizan en el cuaderno de cada area o fotocopiar y enviar fotos a los correos.hasta el 20 de abril
ResponderBorrarCordial saludo, muy Buenas noches!!! Mil gracias por la información y responder los mensajes,pero se requeria. Sin embargo tengo otra duda e inquietud ls asignaturas: Quimica, geometría, estadistica, matemáticas, sociales,los docentes no estipularon ningún correo para el envió, la pregunta es a cual correo o como se va hacer para que los docentes reciban los respectivos trabajos? Por favor le agradezco la orientación, quedare atenta. Feliz noche Bendiciones!!!
BorrarBuenas noches!!! Se me olvido especificar que hablo de los docentes de grado sexto jornada mañana. Muchas gracias
BorrarBuenas tardes mi hijo es de 6 de la tarde pero como ago para imprimir eso trabajos si los ciber están cerrados
ResponderBorrarMuy Buenas tardes!!! Si es tan amable, alguien me podra decir a que correo se le envía los trabajos de las siguientes asignaturas de grado sexto jornada mañana :matemáticas, estadística, geometría, sociales, quimica, la cual no estan estipulados cuando enviaron los temas a resolver. Agradezco la atención prestada, quedo atenta ante cualquier información.
ResponderBorrarBuenas noches.
ResponderBorrarColo están mi preguntan cuando hay que enviar esos trabajos realizados.
Gracias
El 24 de abril tenemos q entregarlos trabajos
BorrarBuenas noches, nos han dicho que el 28 de abril es la entrega
Borrara del trabajo
Están súper fáciles 👍🏻👍🏻👍🏻👍🏻
ResponderBorrarQuiero expresar mi desacuerdo con algunas materias ya que su contenido visual es muy deficiente. Ademas en algunas materias las preguntas o no estan bien planteadas o mal impresas, para su mejor comprension solicito que todas las guias lleven una letra legible y de mayor tamaño ya que algunas son borrosas y al ampliarlas para poder leerlas estas se distorsionan o se pixelean demasiado.
ResponderBorrarEstoy de acuerdo, las guias estan mal preparadas y se encuentran errores en ellas, solo hacen copiar guias de internet
Borrarf
ResponderBorrarBuenas noches, también me encuentro en desacuerdo de la forma en la que algunos profesores estructuraron los trabajos, pantallazos y fotos pixeladas donde no se entiende nada, invito a los profesores con todo el respeto a que se tomen un poco mas el tiempo de organizar mejor los talleres y realizarlos de una forma mas practica.
ResponderBorrary cuando van a comezar las clases virtuales
ResponderBorrar