GUIAS VIRTUALES GRADO OCTAVO
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
TALLER DE INGLES
Nombre: ________________________________________________________
Grado: Octavo Jornada: Tarde Teacher: Luz Marina Arias
Correo Electrónico: luzmarinarias@gmail.com
ESCOJA LA MEJOR OPCIÓN
- Does Nohora paint beautiful?
A. Yes, she does
B. Yes, he does
C. No, they don’t
D. Yes, I do
- Do you drink milk in the afternoon?
A. No, I don’t
B. No
C. No, I do.
D. Yes, I don’t
COMPLETE THE SENTENCES. ESCOJA LA MEJOR OPCIÓN EN FORMA NEGATIVA
- Shakira ___________ live in Barranquilla.
A. don’t
B. doesn’t
C. do not
D. not
- I ___________ play basketball.
A. don’t
B. do
C. not
D. doesn’t
- You ___________ study very hard.
A. are not
B. don’t
C. no
D. not
- Juan Pablo Montoya ___________ live in Neiva
A. doesn’t
B. don’t
C. do not
D. not
ESCOJA LA MEJOR OPCIÓN EN FORMA INTERROGATIVA
- You sing. very well
A. You sing very well?
B. Do you sing very well?
C. Does you sing very well?
D. You do you sing very wel
- They wash their hands, before eating
A. Do they wash their hands before eating?
B. Does they wash their hands before eating?
C. They wash their hands before eating
D. Do they wash their hands before eating?
- The cat goes for a walk.
A. Do the cat go for a walk?
B. Does the cat go for a walk?
C. The Lion goes for a walk.
D. The Lion does go for a walk.
ESCOJA LA MEJOR OPCIÓN EN FORMA AFIRMATIVA
- A. My father work at the office.
B. My father works at the office.
C. My father at the office works.
D. At the office my father works.
- A. We dance cumbia.
B. We dances cumbia.
C. Cumbia we dance.
D. Dance Cumbia we
NOTA:
Atendiendo a las recomendiciones emitidas por la OMS, la Presidencia de la República,
el Ministerio de Salud y el Ministerio de Educación frente al COVID- 19,
iniciaremos un proceso de educación virtual.
el Ministerio de Salud y el Ministerio de Educación frente al COVID- 19,
iniciaremos un proceso de educación virtual.
- Los estudiantes desde sus casas, deben resolver el taller enviado por la docente.
- El respectivo taller debe ser entregado y enviado de manera virtual
- al correo electrónico: luzmarinarias@gmail.com
- La fecha de entrega del taller es el Viernes 27 de Marzo de 2020
AREA DE INGLES JORNADA MAÑANA
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME: ___________________DATE:___________GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN
PRESIDENCIAL.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLINGBEE
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME:__________________________DATE:___________GROUP:_________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL
SPELLING BEE
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME: _________________________DATE: _____________ GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN
PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME:__________________________DATE:____________GROUP:______
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NAME: ______________________________________ DATE: ______________ GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME: _______________________________ DATE: ______________GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME: ____________________________ DATE: ______________GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
NEIVA – HUILA
NAME: _____________________________ DATE: _____________ GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.
Por favor enviarlas al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE
PARA EL SPELLING BEE.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES NEIVA – HUILA
NAME: ______________________________________ DATE: ____________________ GROUP: _________
GUIAS PARA ESTUDIO EN CASA DEL GRADO 8° EN CORRESPONDENCIA A LA ORDEN PRESIDENCIAL.
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas. Por favor enviarlas
al correo electrónico amerikalvarado@gmail.com.
al correo electrónico amerikalvarado@gmail.com.
ADEMAS DEBE REPASAR EL ABECEDARIO EN INGLÉS PREPARANDOSE PARA EL SPELLING BEE.
Guía: Español
Grado: Octavo
Profesor: Olimpo Gallo
Tema:
1. Fenómenos lingüísticos
1. Los sinónimos
2. Los Antónimos
3. Las homófonas
2. División silábica de la palabra.
Actividades:
De acuerdo a las explicaciones dadas en clase elabore oraciones lógicas (10) en las cuales evidencie la utilización de sinónimos, antónimos y homófonas.
2. Con esas 30 oraciones elabore un texto con sentido lógico.
3. Dibuje dicho texto
NOTA ACLARATORIA:
APRECIADO ESTUDIANTE:
TODAS LAS ACTIVIDADES PARA DESARROLLAR EN CASA CONSISTEN EN HACER LA LECTURA DE TODA LA PRESENTE GUÍA, LA CUAL HEMOS TRABAJADO DURANTE LAS CLASES DE BIOLOGÍA Y DESPUÉS DESARROLLAR EL TALLER DE APLICACIÓN Y LA EVALUACIÓN.
POSTERIORMENTE, DEBEN SUBIR AL SIGUIENTE CORREO mairalejandra21@hotmail.com CON EL NOMBRE COMPLETO, GRUPO RESPECTIVO Y ASIGNATURA, LOS DOS TRABAJOS DESARROLLADOS.
PROF. MAIRA ALEJANDRA BERMEO PARRA.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
PLAN DE CLASE
GRADO OCTAVO
ASIGNATURA DE BIOLOGÍA
PRIMER PERÍODO
PROFESORA: Mg. MAIRA ALEJANDRA BERMEO PARRA. mairalejandra21@hotmail.com
Correo electrónico: edgarramirez081154@gmail.com prof. EDGAR JT
NOTA: TRABAJO PROPUESTO PARA DESARROLLAR DURANTE DOS SEMANAS.
FECHA DE ENTREGA MAXIMO VIERNES 1 DE MAYO.
UNIDAD 2: LA FISIOLOGÍA
TEMAS:
Repaso estructura de la célula eucariota.
La membrana celular y el transporte de sustancias.
Estructura de la membrana celular.
Transporte de sustancias de bajo peso molecular.
Transporte de sustancias de alta masa molecular.
COMPETENCIAS A DESARROLLAR:
Básicas, científicas, interpretativas, comprensión, argumentación y proposición.
ESTANDARES:
Verifico y explico los procesos de ósmosis y difusión.
Clasifico membranas de los seres vivos de acuerdo con su permeabilidad frente a diversas sustancias.
OBJETIVO: Verificar y explicar los procesos de ósmosis difusión.
ESTUDIANTE: ________________________________________________________ COD: ______
FASE I: LECTURA RELACIONADA
LECTURA: “TRABAJO EN EQUIPO”
Escrito por: Sofía Carvajal grado 5°C-2010
Hubo una vez en una ciudad llamada celulosa, un catastrófico disturbio que hizo que todo en la célula tuviera que ser reestablecido.
Todo empezó cuando las mitocondrias se aburrieron de intercambiar gases por energía y se fueron a quejar al núcleo para que reorganizara sus trabajos, pero el núcleo no podía reemplazarlas porque nadie sabía esta función.
Así fue que las mitocondrias dejaron de hacer su función y la célula se desactivó por no tener energía, el retículo endoplasmático dejó de enviar proteínas y el negocio tuvo que cerrar.
Los ribosomas no podían producir proteínas y las vacuolas se quedaron sin espacio en sus bodegas, perdiéndose así el material producido. La membrana celular no podía abrir sus puertas automáticas y nada pudo salir ni entrar.
Llenos de ira los organelos se revelaron y volcaron un camión del retículo y acorralaron a las mitocondrias, cuando se disponían a digerirlas con el ácido y las enzimas digestivas del lisosoma, algo las detuvo.
Todo empezó a ponerse negro y se oyeron unos poderosos golpes que provenían de la puerta, lo peor había llegado...
Los atacaba una enfermedad y ahora estaba asediando la puerta, las mitocondrias tomaron acción evasiva y empezaron a darle
energía a la célula al doble de rápido. Todos se unieron a atacar al virus y las mitocondrias aprendieron su lección, pero sus compañeros
siempre las llamaron haraganas y holgazanas.
Teniendo en cuenta la lectura responda:
¿Qué es una célula?
¿Por qué son importantes las células para los seres vivos?
¿Dónde podemos encontrar células?
¿Por qué es importante estudiar las células?
Dibuje una célula.
¿Cuáles son las funciones de la célula?
¿Qué características tienen las células?
Mencione cinco ideas acerca de la lectura.
Explique ¿qué significa que la célula sea la unidad estructural, funcional y reproductiva de todo ser vivo?
¿Qué diferencias encuentra entre organismos unicelulares y pluricelulares?
FASE II y III: TEORIA Y CONCEPTOS BÁSICOS.
LA MEMBRANA CELULAR Y EL TRANSPORTE DE SUSTANCIAS
MODELO DE MOSAICO FLUIDO.
FOSFOLÍPIDOS:
Se encuentran en mayor cantidad en la membrana celular y tienen las siguientes partes:
Hidrófila, hidrofílica: (gusto por el agua). Moléculas o sustancias que tiene afinidad por el agua, se pueden mezclar con ella. Estas sustancias se llaman polares. Eje: alcohol.
Hidrófoba, hidrofóbica: (miedo al agua). Moléculas o sustancias que no se pueden mezclar con el agua. Estas sustancias son apolares. Eje: aceite. Aunque no pueden mezclarse con el agua si lo hacen con las sustancias de su misma naturaleza como los lípidos.
Anfipática: moléculas que tienen regiones polares y apolares. de manera que una parte de la molécula (la polar) interacciona con el agua y la otra (la apolar) no.
Los fosfolípidos se disponen en una bicapa lipídica con sus colas hidrofóbicas dirigidas hacia el interior las cuales se mezclan con las sustancias apolares; y con sus cabezas hidrofílicas situadas en la superficie externa e interna de la membrana e interactúan con las sustancias polares.
PROTEINAS:
Pueden ser integrales o periféricas. Son los carritos transportadores.
Integrales: atraviesan la membrana. También tienen regiones hidrofóbicas, aquellas que se insertan en la membrana; y regiones hidrofílicas que sobresalen hacia el exterior e interior de la célula (antipáticas). Están unidas fuertemente a la membrana. Su separación implica daño a la bicapa lipídica.
Periféricas: unidas a la superficie de la membrana (tanto en el dominio extracitosólico como citosólico), de forma más débil, por lo que son más fáciles de extraer. No poseen región hidrofóbica.
COLESTEROL:
Es un importante constituyente de la membrana ya que aumenta su fluidez.
GLUCOLÍPIDOS:
Glucosa adherida a lípido (fosfolípido). Se encuentran en la superficie externa de la membrana. Son los receptores de membrana. Reconociendo las moléculas que se acercan a la célula.
GLUCOPROTEÍNAS:
Glucosa adherida a proteína.
PERMEABILIDAD DE LA MEMBRANA.
La membrana celular es selectivamente permeable. Algunas partículas cruzan la membrana libremente, algunas necesitan ayuda (proteínas transportadoras) para hacerlo y otras al ser muy grandes no pueden cruzar. De este modo la célula asegura un medio interno adecuado para vivir.
1. TRANSPORTE DE SUSTANCIAS DE BAJA MASA MOLECULAR
ÓSMOSIS:
Es la entrada o salida de agua (solvente) en la célula para regular la concentraciones de sales (solutos) disueltas tanto en el citoplasma (medio interno) como en el medio externo. Si a ambos lados de la membrana se ponen dos soluciones de concentración diferente, el agua pasa desde las más diluida (menos solutos) a la mas concentrada (mas solutos). Y entendemos por presión osmótica, a aquella que seria necesaria para detener el flujo de agua a través de la membrana semipermeable.
Solución Hipotónica: La concentración de sales es mayor dentro de la célula que fuera de esta.
Solución Isotónica: La concentración de sales es igual dentro y fuera de la célula.
Solución Hipertónica: La concentración de sales es mayor en el exterior de la célula que en su interior.
TRANSPORTE PASIVO:
Es un transporte a favor del gradiente de concentración (cuesta abajo), por lo que NO requiere de energía. El transporte pasivo es también llamado difusión. La difusión se refiere a la dispersión de las moléculas por movimientos al azar. Puede ser: difusión simple o difusión facilitada.
Difusión simple: Movimiento de partículas a favor del gradiente, a través de la bicapa lipídica de la membrana celular. Las sustancias que se difunden son las apolares o lipófilas como el O2, CO2, lípidos solubles como hormonas asteroideas.
Difusión Facilitada: Las sustancias polares se mueven a favor del gradiente pero utilizando proteínas que faciliten su paso. Estas proteínas para ser efectivas pueden ser:
Proteínas canal: forman poros hidrofílicas que permiten al agua y ciertos iones cruzar la membrana.
Proteínas portadoras: se unen a los solutos específicos como glucosa y los llevan a través de la membrana.
TRANSPORTE ACTIVO:
Transporte en contra del gradiente de concentración en todos los casos requiere gasto de energía (ATP) y proteínas transportadoras. El ATP (adenosin trifosfato) se hidroliza transfiriendo un grupo fosfato liberando la energía necesaria para transportar las sustancias cuesta arriba.
Bomba Sodio-Potasio: La bomba de sodio-potasio es crucial e imprescindible para que exista la vida animal ya que tiene diversas funciones. Por ello se encuentra en todas las membranas celulares de los animales, en mayor medida en células excitables como las células nerviosas y células musculares. La bomba de sodio (Na+) –potasio (K+) bombea Na+ fuera de la célula, mientras transporte K+ al interior. Mueve tres Na+ para afuera por dos K+ hacia adentro lo cual genera una polarización de la membrana, requerida para la actividad del sistema nervioso.
TRANSPORTE DE SUSTANCIAS DE ALTA MASA MOLECULAR
ENDOCITOSIS:
Es el proceso mediante en el cual las partículas son transportadas al interior de la célula, envueltas en vesículas formadas a partir de la membrana. Cuando lo que entra a la célula son partículas sólidas o liquidas el transporte se realiza por mecanismos especiales.
Fagocitosis: Ingestión de grandes partículas solidas (polisacáridos, proteínas, bacterias, restos celulares). La célula crea proyecciones de la membrana y el citoplasma llamadas pseudópodos que envuelven la partícula solida. Luego se forma una vesícula fagocítica o fagosoma. El material sólido dentro de la vesícula es seguidamente digerido por enzimas.
Pinocitosis: Ingestión de sustancias disueltas en forma de pequeñas gotas (por lo general proteínas disueltas). En este caso no se forman pseudópodos, sino que la membrana se repliega (contrae) creando una vesícula pinocítica.
EXOCITOSIS:
Es el proceso mediante el cual las partículas son expulsadas hacia el exterior de la célula. Se realiza por medio de vesículas de exocitosis que se fusionan con la membrana plasmática abriéndose al exterior y expulsando su contenido.
TRANSISTOSIS:
Implica el doble proceso endocitosis-exocitosis.
FASE IV: TALLER DE APLICACIÓN.
La difusión simple a través de una membrana
A) genera energía libre
B) está mediada por permeasas
C) está gobernada por la ley de Fick
D) permite el paso de ciertos gases
Pregunta nº 2 (Múltiple Elección): El transportador de glucosa del eritrocito
A) es una proteína integral de la membrana
B) transporta la glucosa en contra del gradiente de concentración
C) sufre cambios conformacionales durante el transporte
D) puede transportar otras moléculas parecidas a la glucosa
Pregunta nº 3 (Múltiple Elección): El transporte activo secundario
A) consiste en el transporte de moléculas a favor de su gradiente de concentración
B) libera energía
C) no está asociado a la hidrólisis del ATP
D) también se llama cotransporte
Pregunta nº 4 (Múltiple Elección):Gracias al transporte activo
A) la célula genera energía
B) la célula regula su composición interna
C) podemos afirmar que la membrana posee permeabilidad selectiva
D) la célula desplaza iones o moléculas a favor de su gradiente de concentración
Pregunta nº 5 (Múltiple Elección): La difusión facilitada
A) es más rápida que la difusión pasiva
B) necesita un aporte de energía
C) sigue una cinética Michaeliana
D) está mediada por permeasas
Pregunta nº 6 (Múltiple Elección): Las permeasas
A) pueden transportar moléculas contra el gradiente de concentración
B) son proteínas que se encuentran en el citoplasma celular
C) son muy específicas respecto al tipo de molécula que transportan
D) nunca se saturan
Pregunta nº 7 (Múltiple Elección): Si dos sustancias tienen distinto coeficiente de partición (K)
A) no atraviesan la membrana
B) la atraviesan con la misma velocidad
C) la que tenga mayor K pasará más rápido
D) la que tenga mayor K pasará más despacio
Pregunta nº 8 (Múltiple Elección): El papel de la banda III del eritrocito en el intercambio gaseoso en capilares y pulmones es un claro ejemplo de
A) transporte activo primario
B) difusión facilitada
C) transporte activo secundario
D) cotransporte
Pregunta nº 9 (Múltiple Elección): La velocidad de difusión simple de una molécula a través de una membrana depende de
A) su coeficiente de partición
B) el área de la membrana
C) el espesor de la membrana
D) la suma de las concentraciones de esa sustancia a ambos lados de la membrana
Pregunta nº 10 (Múltiple Elección): El transporte activo asociado a la hidrólisis del ATP
A) permite regular la concentración intracelular de ciertos iones
B) ayuda al mantenimiento de una diferencia de potencial a ambos lados de la membrana
C) ayuda a controlar el volumen celular
D) en ciertos casos, puede funcionar en sentido inverso y generar ATP
FASE V: EVALUACIÓN.
1. En la ÓSMOSIS, un disolvente (a menudo agua) se mueve desde una zona de baja concentración de solutos hacia una zona de alta concentración de solutos, a través de una membrana semipermeable. Aquí, las moléculas de agua se difunden en la disolución concentrada de azúcar debido a que son lo suficientemente pequeñas como para poder moverse a través de la membrana; las moléculas de azúcar, de mayor tamaño, son incapaces de atravesarla. La ósmosis finaliza cuando las dos disoluciones alcanzan la misma concentración a cada lado de la membrana. La tendencia natural de las moléculas a moverse desde zonas de alta concentración hacia zonas de baja concentración se llama DIFUSIÓN.
Si una célula animal se coloca en una solución cuya concentración de sustancias disuelta es más alta que el interior de la célula,
A. la célula se hinchará
B. la célula se encogerá
C. la célula conservara su tamaño
D. la célula se vuelve impermeable
2. Si colocas agua en un vaso e introduces en él una bolsa de papel celofán con tinta en su interior, es válido suponer que:
A. El agua pasará al interior de la bolsa por el fenómeno de osmosis, en el que las sustancias pasan de un sitio de menor concentración a uno de mayor concentración
B. La tinta pasará al agua del vaso por efecto de la difusión facilitada, en la cual las sustancias pasan de una zona de menor concentración a una de menor concentración, con ayuda de las proteínas de la membrana
C. La tinta pasará al agua del vaso por efecto de la difusión simple, en la cual las sustancias pasan de una zona de menor concentración a una de menor concentración
D. No sucederá ningún cambio
3. La principal diferencia entre la osmosis y la difusión está en que:
A. El movimiento de las sustancias se da por diferencias de concentraciones
B. Las sustancias pueden entrar y salir de la célula por cualquiera de estos dos procesos
C. La concentración de las sustancias influye en el movimiento de las partículas a través de las membranas
D. Osmosis: se difunde el agua y la difusión paso de otras sustancias a través de la membrana.
4. Si consumes unas cantidades muy altas de sal el potasio que la conforma pasará a tu sangre y llegará a tus células, si en el interior de la célula hay muy pocas cantidades de potasio, para equilibrar la cantidad de potasio al interior y exterior de la célula:
A. El potasio entra a la célula por el fenómeno de difusión
B. El potasio sale de la célula por el proceso de osmosis
C. El potasio entra y sale de la célula
D. No se puede equilibrar las cantidades de potasio
https://encrypted-tbn1.gstatic.com/images?q=tbn:ANd9GcR7XwvAJrsGEaK7r-fsbx7pfQzUap39-O93Ai0Hf3NM2IamxRx_7A5. Cuando una célula se pone en contacto con una solución salina de concentración inferior (solución hipotónica), se establece una corriente de agua hacia el interior de la célula que dilatará enormemente dicha vacuola, comprimiéndola contra la membrana (fenómeno de turgencia). Cuando esto ocurre en el caso de los eritrocitos (glóbulos rojos), el proceso se denomina hemólisis. Por el contrario, si la solución que se pone en contacto con la célula es de mayor concentración que el líquido vacuolar (solución hipertónica), ocurrirá lo contrario, es decir, que la vacuola expulsará agua y, en consecuencia, se reducirá de tamaño, “arrugándose” y despegándose” de la membrana celular (fenómeno de plasmólisis, conocido como crenación en los glóbulos rojos). Por último, decimos que dos soluciones son isotónicas cuando ambas poseen igual concentración y, por tanto, no existe flujo de agua entre ellas a través de la membrana semipermeable.
Analizando el anterior dibujo podemos afirmar que la solución en la que se encuentran sumergidas las células del recipiente A, B y C corresponde respectivamente a un medio
A. Hipotónico, isotónico e hipertónico
B. Isotónico, hipertónico e hipotónico
C. Hipertónico, isotónico e hipotónico
D. Isotónico, hipotónico e hipertónico
6. Imagina que eres un camarón joven y que vives en un estuario, donde el agua dulce que se drena de la tierra se mezcla con el agua salina del mar. Muchas personas tienen casas cercanas a lagos y desean tener acceso hacia el mar para sus botes, por lo que solicitan autorización al gobierno para construir un canal hacia el estuario. Si se las concedieran, ¿qué te ocurriría, camarón?
A. Aumentaría el área geográfica y el número de individuos de la población
B. Perecerían muchos organismos por la pérdida de concentración hídrica de sus células
C. Perecerían muchos organismos por aumento de concentración hídrica al interior celular
D. Se enfrentarían a un gradual proceso de selección natural
CONTESTAR LAS PREGUNTAS 7 Y 8 TENIENDO EN CUENTA LA SIGUIENTE INFORMACIÓN
Una de las funciones más importantes de las vesículas o vacuolas es transportar materiales hacia la membrana plasmática y desde ella hacia el interior de la célula; constituyen de este modo un medio de comunicación entre el interior celular y el medio externo. Hay un intercambio continuo de materiales entre el retículo endoplasmático, el aparato de Golgi, los lisosomas y el exterior celular. Dicho intercambio está mediado por pequeñas vesículas delimitadas por membrana que se forman a partir de una membrana y se fusionan con otra.
Así, en la superficie celular siempre hay porciones de membrana plasmática que se invaginan y separan para formar vesículas que transportan hacia el interior de la célula macromoléculas y partículas capturadas en el medio externo; este fenómeno se llama endocitosis, y permite a la célula engullir partículas muy grandes e incluso células extrañas completas. Existen dos tipos de endocitosis: la pinocitosis, que consiste en la ingestión de líquidos y sólidos pequeños; y la fagocitosis, para la ingestión de grandes partículas. El fenómeno opuesto, llamado secreción o exocitosis, se realiza por la fusión de las vesículas internas con la membrana plasmática seguida de la liberación de su contenido al medio externo; es también común en muchas células.
7. La entrada de sustancias a la célula se realiza por los procesos de:
A. Osmosis y difusión
B. Fagocitosis y exocitosis
C. Pinocitosis y fagocitosis
D. A la célula no entran sustancias por ningún proceso
8. Después de realizar los procesos de nutrición y respiración, la célula llega cargada de desechos, por lo que.
A. Se producen vesículas o vacuolas al interior de la célula para que estas destruyan los desechos
B. Se producen vesículas o vacuolas al interior de la célula que se dirigen hacia la membrana plasmática y se unen a ella, permitiendo la salida de los desechos
C. Se producen vesículas o vacuolas al interior de la célula que transportan al interior de la célula los desechos
D. Después de realizar los procesos de nutrición y respiración, la célula no queda cargada de desechos
9. La existencia de moléculas solubles en lípidos y moléculas no solubles en lípidos, genera dos modos importantes de transporte de moléculas a través de la membrana lipídica que rodea la célula: Difusión simple donde las moléculas atraviesan la capa lipídica y Transporte mediado por proteínas insertas en la capa lipídica (canales y transportadores). La cantidad de moléculas que en un lapso de tiempo ingresan al interior de la célula depende de: el tipo de molécula y la concentración de la molécula en el exterior como se ilustra:
El límite en la cantidad de moléculas no solubles en lípidos que entran a la célula por segundo es una consecuencia de:
A. El área de la membrana celular
B. El tamaño de las moléculas solubles en lípidos
C. La disponibilidad de las proteínas de transporte
D. La afinidad entre proteínas y moléculas solubles en lípidos
10. Las células de la tiroides intercambian yodo con su medio únicamente a través de ciertas proteínas de la membrana celular especializadas en esta función. En condiciones normales y dados los requerimientos de estas células, el yodo entra a la célula por transporte activo a través de cierta proteína, en contra del gradiente de concentración, y sale por difusión facilitada a través de otro tipo de proteína siempre a favor de un gradiente de concentración. Se descubrió que cierta sustancia venenosa puede dañar las proteínas encargadas del transporte activo del yodo por lo que no pueden continuar cumpliendo su función de transporte. Si en un individuo las células de la tiroides entran en contacto con esta sustancia, la concentración de yodo en el interior celular
A. Disminuirá progresivamente gracias a la difusión facilitada hasta que iguale la concentración del exterior celular
B. Seguirá siendo menor que el del exterior celular indefinidamente gracias a que la difusión facilitada sigue actuando
C. Seguirá siendo mayor que el del exterior celular indefinidamente gracias a que la difusión facilitada sigue actuando
D. Desaparecerá pues todo el contenido de yodo saldrá de la célula por la difusión facilitada
NOTA ACLARATORIA:
APRECIADO ESTUDIANTE:
TODAS LAS ACTIVIDADES PARA DESARROLLAR EN CASA CONSISTEN EN HACER LA LECTURA DE TODA LA PRESENTE GUÍA, LA CUAL HEMOS TRABAJADO DURANTE LAS CLASES DE QUÍMICA Y DESPUÉS DESARROLLAR EL TALLER DE APLICACIÓN Y LA EVALUACIÓN.
ENVIAR AL CORREO mairalejandra21@hotmail.com
PROF. MAIRA ALEJANDRA BERMEO PARRA.
INSTITUCIÓN EDUCATIVA ANGEL MARIA PAREDES
PLAN DE CLASE
GRADO OCTAVO
ASIGNATURA DE QUÍMICA
PRIMER PERÍODO
PROFESORA: Mg. MAIRA ALEJANDRA BERMEO PARRA.
UNIDAD 1: EL LENGUAJE DE LA QUÍMICA.
TEMAS:
Fórmulas químicas.
Número de oxidación.
Compuestos químicos.
La notación científica.
Conversión de unidades.
COMPETENCIAS A DESARROLLAR: Básicas, científicas, interpretativas, comprensión, argumentación y proposición.
ESTANDAR: Comparo masa, peso, cantidad de sustancia y densidad de diferentes materiales.
OBJETIVO: Reconocer la importancia del lenguaje de la química para comprenderla.
ESTUDIANTE: ___________________________________________________COD: ______
FASE I:LECTURA RELACIONADA.
“El carnaval de los elementos”
El laboratorio parecía un salón de fiesta. Desde afuera se escuchaba el bullicio de los invitados que venían llegando. Tres niños que pasaban por el pasillo se asomaron a observar qué ocurría adentro. ¡Cuál no sería su asombro cuando vieron a los elementos químicos en plena fiestoca!
En primer plano estaba el infaltable y amarillo azufre, recibiendo a algunos invitados. También hacía de anfitrión el Magnesio, siempre enrollado como una cinta, finamente laminado. El señor Oro lucía más hermoso que nunca, su rubia melena brillaba intensamente. Para que decir doña Plata, se movía cadenciosamente y producía un sonido que parecía música; su brillo blanco plateado como un rayo de luna iluminaba el laboratorio.
En eso llegó don Mercurio cual río plateado encerrado en un frasco, por lo tanto, no podía participar plenamente, pues si se salía de su encierro quedaba desparramado en el suelo como perlitas brillantes. Lloraba porque quería sacar a bailar a dona Plata; pero ésta siempre se le escapaba porque cuando ambos se juntaban se mezclaban tanto que quedaban transformado en amalgama.
Torpe y pesadamente avanza don Plomo, haciéndole el quite a la estufa que estaba encendida. Si se acercaba el calor lo podía ablandar y finalmente fundirlo. Las láminas de Aluminio danzaba ligeramente y hacían lo posible porque no hubieran discusiones, pues con cualquier golpe podrían quedar abolladas.
Las limaduras de hierro se acercaban rápidamente, sin darse cuenta que había un imán, el que las atrapó. Allí quedaron sin poder desprenderse. Sólo lograron observar cómo los demás se divertían. Alguien tomó un pedacito de cinta de Magnesio y lo tiró como si fuera una serpentina. Al caer sobre el mechero encendido, ardió liberando una luz blanca, enceguecedora, brillante, que produjo un resplandor en el recinto.
Carli, uno de los niños, dice: Mira Tito, ahora están tirando fuegos artificiales. ¡Esta si que es fiesta Química!. No hablan nada, pero sí se ven como es cada uno, y son muy divertidos.
En ese momento hace su aparición el joven Yodo dentro de un vasito de vidrio, luciendo su ropaje de color gris metálico que muy pocos conocen. Habitualmente me identifican como un líquido de color café que es la tintura de Yodo, agrega este elemento. Alguien lo deja encima del anafre que estaba encendido y de pronto empiezan a aparecer gases de hermoso color violeta. Por eso lo llaman Yodo, que significa Yodo en griego.
- ¡Oh! - exclaman todos los invitados. ¡Qué gran espectáculo!
La fiesta siguió y culminó con un gran baile, algunos formaron pareja, pero otros, como el Oro y el Patino se sentaron sin juntarse con nadie.
Los demás elementos comentaban:
Siempre ten engreídos, se creen porque los llaman Metales Nobles.
El colorín cobre se incorporó atrasado a la fiesta, se demoró tratando de sacarse esas pecas verdosas que le salen de vez en cuando. Se sentó a descansar y observa como doña Cloro intentaba conquistar al Oro, pero era inútil, él se mostraba reacio a formar pareja.
Menos mal que el Bromo permaneció encerrado en una ampolleta de vidrio, luciendo su color rojizo. Sí se hubiera salido una gotita siquiera, habría sido como sí hubiera estallado una bomba lacrimógena dentro del laboratorio. Algunas parejas se estaban retirando, el Oxígeno se iba tomado de las dos manos del Carbono.
¡Qué lástima! Exclamaron los niños. Se acabó la diversión, vamos a clase ahora.
Nadie va a creer sí contamos lo que hemos visto. ¿Habrá sido un sueño? Preguntó Rolando.
Tito contesta:
No, la Química puede ser muy hermosa como la vimos recién. Es fantástica como magia toda depende como la veamos. Y eso depende mucho del profe ¿no creen?
Ya, ya dice Chimi -vamos que estamos atrasados.
ACTIVIDADES DE EL CARNAVAL DE LOS ELEMENTOS.
1.- Escribe las características de los elementos:
a) Magnesio.
b) Azufre.
c) Oro.
d) Plata.
e) Mercurio.
f) Plomo.
g) Aluminio.
h) Hierro.
i) Yodo.
j) Bromo.
2.- ¿Qué elementos formaron pareja?
3.- ¿Qué representan las pecas verdes del cobre?
FASE II Y III: TEORÍA Y CONCEPTOS.
LENGUAJE DE LA QUÍMICA
En QUÍMICA se utiliza un lenguaje especial a base de símbolos, símbolos químicos, fórmulas químicas, ecuaciones químicas y signos comunes.
Para poder describir los compuestos químicos y las reacciones que se dan entre ellos de forma precisa y sencilla, la comunidad científica vio necesario adoptar un lenguaje cómodo, fácil de entender y común para todos.
SÍMBOLOS QUÍMICOS
Para empezar, cada elemento debía representarse con un símbolo diferente, ya que son las piezas básicas de las sustancias químicas: combinándolos sirven para representar cualquier sustancia de forma inequívoca.
En la antigüedad, los símbolos eran identificados con los siete planetas conocidos, ya que química y alquimia eran lo mismo y estaban muy relacionadas con la astrología.
Dalton, el creador de la teoría atómica, propuso usar la inicial del nombre del elemento y representar los elementos en distintos círculos para mostrar las moléculas de cada compuesto mediante el número necesario de círculos.
Muy poco después, Berzelius suprimió los círculos, quedándose sólo con la inicial del nombre latino de cada elemento... Si la inicial de dos elementos coincidía, se añadía al símbolo alguna de las letras siguientes.
JACOB BERZELIUS
Algunos símbolos de los elementos químicos son:
Una vez aceptada la forma de llamar a los elementos químicos, podía desarrollarse la estructura de las fórmulas químicas de los compuestos, o lo que es lo mismo, cómo representar la composición de un compuesto o cómo explicar los distintos átomos que forman sus moléculas.
Para ello, se indican los elementos que forman el compuesto, mediante sus símbolos. Si hay más de un átomo de un elemento, se indica con subíndice: por ejemplo, la fórmula más conocida, H2O, explica que la molécula del agua está compuesta por dos átomos de hidrógeno y uno de oxígeno.
FÓRMULAS
Es un conjunto de símbolos destinados a representar la composición química de una sustancia compuesta.
En otras palabras, constituye la combinación adecuada de los símbolos de los átomos que integran una molécula.
Una fórmula química suministra información acerca de la clase de átomos y del número relativo de estos que forman una sustancia. También debe informar si representan moléculas, iones o cristales; por ejemplo, la fórmula del óxido de aluminio: nos indica que en una molécula del compuesto está presente dos átomos e aluminio y tres átomos de oxígeno.
Ejemplos de fórmulas químicas son:
Por otra parte la escritura de las formulas puede ser condensada, semidesarrollada o desarrollada. Como en el siguiente ejemplo se muestra una fórmula desarollada.
Las reacciones químicas se representan mediante ecuaciones químicas.
ECUACIONES QUÍMICAS:
El estado físico de los reactivos y productos puede indicarse mediante los símbolos (g), (l) y (s), para indicar los estados gaseoso, líquido y sólido, respectivamente y se suele usar (ac) para indicar que una sustancia se encuentra en disolución acuosa.
Por ejemplo:
2 CO(g) + O2(g) ® 2 CO2(g)
2 HgO(s) ® 2 Hg(l) + O2(g)
2 HCl(ac) + Zn(s) ® ZnCl2(ac) + H2(g)
Además en química para representar a las moléculas de los compuestos se utilizan MODELOS TRIDIMENSIONALES. Por ejemplo:
ACTIVIDAD:
Ahora te invito a observar detenidamente estos videos acerca del tema, te ayudará a comprenderlo más fácilmente.
Escribe el significado de los conceptos relacionados con el tema, el lenguaje de la química.
Elemento químico.
Un elemento químico es un tipo de materia constituida por átomos de la misma clase. En su forma más simple, posee un número determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada por su número atómico, aun cuando este pueda desplegar distintas masas atómicas.
Es un átomo con características físicas únicas, aquella sustancia que no puede ser descompuesta mediante una reacción química, en otras más simples. Pueden existir dos átomos de un mismo elemento con características distintas y, en el caso de que estos posean número másico distinto, pertenecen al mismo elemento pero en lo que se conoce como uno de sus isótopos. También es importante diferenciar entre los «elementos químicos» de una sustancia simple. Los elementos se encuentran en la tabla periódica de los elementos.
El ozono (O3) y el dioxígeno (O2) son dos sustancias simples, cada una de ellas con propiedades diferentes. Y el elemento químico que forma estas dos sustancias simples es el oxígeno (O).
Algunos elementos se han encontrado en la naturaleza y otros obtenidos de manera artificial, formando parte de sustancias simples o de compuestos químicos. Otros han sido creados artificialmente en los aceleradores de partículas o en reactores atómicos. Estos últimos suelen ser inestables y solo existen durante milésimas de segundo. A lo largo de la historia del universo se han ido generando la variedad de elementos químicos a partir de nucleosíntesis en varios procesos, fundamentalmente debidos a estrellas.
Los nombres de los elementos químicos son nombres comunes y como tales deben escribirse sin mayúscula inicial, salvo que otra regla ortográfica lo imponga.
Símbolo químico
Los símbolos químicos son abreviaciones o signos que se utilizan para identificar los elementos y compuestos químicos. Algunos elementos de uso frecuente y sus símbolos son: carbono, C; oxígeno,O; nitrógeno, N; hidrógeno, H; cloro, Cl; azufre, S; magnesio, Mg; aluminio, Al; cobre, Cu; argón, Ar; oro, Au; hierro, Fe; plata, Ag; platino, Pt. Fueron propuestos en 1814 por Berzelius en remplazo de los símbolos alquímicos y los utilizados por Dalton en 1808 para explicar su teoría atómica.
La mayoría de los símbolos químicos se derivan de las letras griegas del nombre del elemento, principalmente en latín, pero a veces en inglés, alemán, francés o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda (si la hay) con minúscula. Los símbolos de algunos elementos conocidos desde la antigüedad, proceden normalmente de sus nombres en latín. Por ejemplo, Cu de cuprum (cobre), Ag de argentum (plata), Au de aurum (oro) y Fe de ferrum (hierro). Este conjunto de símbolos que denomina a los elementos químicos es universal. Los símbolos de los elementos pueden ser utilizados como abreviaciones para nombrar al elemento, pero también se utilizan en fórmulas y ecuaciones para indicar una cantidad relativa fija del mismo. El símbolo suele representar un átomo del elemento en una molécula u otra especie química. Sin embargo, los átomos tienen unas masas fijas, denominadas masas atómicas relativas, por lo que también representa un mol.
Fórmula química.
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura química. Ejemplo: La fórmula general de los silanos es SinHm.
A veces, los miembros de una familia química se diferencian entre sí por una unidad constante, generalmente un átomo de carbono adicional en una cadena carbonada.
Existen varios tipos de fórmulas químicas:
Fórmula molecular
La fórmula molecular indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada elemento de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.
Fórmula semidesarrollada
La fórmula semidesarrollada es similar a la anterior, pero indicando los enlaces entre los distintos grupos de átomos para resaltar, sobre todo, los grupos funcionales que aparecen en la molécula. Es muy usada en química orgánica, donde se puede visualizar fácilmente la estructura de la cadena carbonada y los diferentes sustituyentes. Así, la glucosa tendría la siguiente fórmula semidesarrollada:
CH_{2}OH-CHOH-CHOH-CHOH-CHOH-CHOCH_{2}OH-CHOH-CHOH-CHOH-CHOH-CHO}
Fórmula desarrollada
La fórmula desarrollada es más compleja que la fórmula semidesarrollada. Indica todos los enlaces representados sobre un plano cartesiano, que permite observar ciertos detalles de la estructura que resultan de gran interés.
Fórmula estructural
La fórmula estructural es similar a las anteriores, pero señalando la geometría espacial de la molécula mediante la indicación de distancias, ángulos o el empleo de perspectivas en diagramas bi o tridimensionales.
Fórmula de Lewis
La fórmula de Lewis, diagramas de Lewis o estructura de Lewis de una molécula indica el número total de átomos de esa molécula con sus respectivos electrones de valencia (representados por puntos entre los átomos enlazados o por una rayita por cada par de electrones). No es recomendable para estructuras muy complejas.
Diagramas
En un diagrama 2D, se aprecia la orientación de los enlaces usando símbolos especiales. Una línea continua representa un enlace en el plano; si el enlace está por detrás, se representa mediante una línea de puntos; si el enlace está por delante, se indica con un símbolo en forma de cuña triangular. A veces se emplean otro tipo de convenios o proyecciones para grupos de compuestos específicos (proyección de Newman, diagramas de Tollens, etc).
Fórmula general
La fórmula general de un grupo de compuestos puede representarse de diferentes maneras:
Expresando el número de átomos de cada clase
En química inorgánica, una familia de compuestos se puede representar por una fórmula general cuyos subíndices (número de átomos de cada clase) son variables (x, y, z.).
Incluyendo expresiones matemáticas en los subíndices
En química orgánica, es frecuente que los subíndices sean expresiones matemáticas que incluyen la variable n (número de átomos de carbono). Se llama serie homóloga al conjunto de compuestos que comparten la misma fórmula general. Por ejemplo, la fórmula general de los alcoholes es: CnH(2n + 1)OH (donde n ≥ 1)
Fórmula molecular
La fórmula molecular expresa el número real de átomos que forman una molécula a diferencia de la fórmula química que es la representación convencional de los elementos que forman una molécula o compuesto químico. Una fórmula molecular se compone de símbolos y subíndices numéricos; los símbolos corresponden a los elementos que forman el compuesto químico representado y los subíndices son la cantidad de bebes presentes de cada elemento en el compuesto. Así, por ejemplo, una molécula de ácido sulfúrico, descrita por la fórmula molecular H2SO4 posee dos átomos de hidrógeno, un átomo de azufre y cuatro átomos de oxígeno. El término se usa para diferenciar otras formas de representación de estructuras químicas, como la fórmula desarrollada o la fórmula esqueletal. La fórmula molecular se utiliza para la representación de los compuestos inorgánicos y en las ecuaciones químicas. También es útil en el cálculo de los pesos moleculares.
Fórmula molecular Nombre
Na2O óxido de sodio
K2O óxido de potasio
MgO óxido de magnesio
Hidróxidos
Fórmula molecular Nombre
NaOH hidróxido de sodio
KOH hidróxido de potasio
Ca(OH)2 hidróxido de calcio
Mg(OH)2 hidróxido de magnesio
Óxidos ácidos
Fórmula molecular Nombre
N2O óxido nitroso
NO2 dióxido de nitrógeno
SO2 dióxido de azufre
SO3 trióxido de azufre
Ácidos
Fórmula molecular Nombre
HCl ácido clorhídrico
H3PO4 ácido fosfórico
H2SO3 ácido sulfuroso
H2SO4 ácido sulfúrico
Sales
Fórmula molecular Nombre
NaCl cloruro de sodio
Na3PO4 fosfato de sodio
Na2SO3 sulfito de sodio
Na2SO4 sulfato de sodio
NOMENCLATURA QUÍMICA
La nomenclatura química (del latín nomenclatura) es un conjunto de reglas o fórmulas que se utilizan para nombrar los compuestos químicos. La IUPAC (Unión Internacional de Química Pura y Aplicada; en inglés International Union of Pure and Applied Chemistry) es la máxima autoridad en esta materia, y se encarga de establecer las reglas correspondientes.
Sistema de nomenclatura para compuestos inorgánicos
Artículo principal: Nomenclatura química de los compuestos inorgánicos
Este sistema de nomenclatura agrupa y nombra a los compuestos inorgánicos, que son todos los compuestos diferentes de los orgánicos. Actualmente se aceptan tres sistemas o subsistemas de nomenclatura, estos son: el sistema de nomenclatura estequiométrica o sistemático, el sistema de nomenclatura funcional o clásico o tradicional y el sistema de nomenclatura Stock. Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa, y tiene grandes ramas del desarrollo físico y alternativo, y lleva a cabo varias interpretaciones de las funciones básicas de cada elemento.
Función química
Se le llama función química al conjunto de propiedades comunes que caracterizan a una serie de sustancias, permitiendo así diferenciarlas de las demás. Este tipo de sustancias tienen un comportamiento propio y específico en los procesos químicos. Por ejemplo: Óxidos, Ácidos, Sales, Hidróxidos.
Óxido
Una puerta de FLRS oxidada está recubierta por una capa de óxido férrico denominada herrumbre, que no es impermeable a una ulterior oxidación.
Un óxido es un compuesto químico, formado por al menos un átomo de oxígeno y un átomo de algún otro elemento. El átomo de oxígeno normalmente presenta un estado de oxidación (-2). Existe una gran variedad de óxidos, los cuales se presentan en los 3 principales estados de agregación de la materia: sólido, líquido y gaseoso, a temperatura ambiente. Casi todos los elementos forman combinaciones estables con el oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes.
Por ejemplo los óxidos el óxido nítrico (NO) o el dióxido de nitrógeno (NO2). Los óxidos son muy comunes y variados en la corteza terrestre. Los óxidos no metálicos también son llamados anhídridos, 3porque son compuestos que han perdido una molécula de agua dentro de sus moléculas. Los metales pueden mezclarse con el oxígeno (O). Por ejemplo, al hidratar anhídrido carbónico en determinadas condiciones puede obtenerse ácido carbónico:
CO2 + H2O = H2CO3
En general, los ácidos se pueden sintetizar directamente mediante procesos de oxidación; por ejemplo, óxidos básicos con elementos metálicos (alcalinos, alcalinotérreos o metales de transición) como el magnesio:
2Mg + O2 = 2 MgO o bien óxidos ácidos con elementos no metálicos, como el fósforo: P4 + 5O2 = 2 P2O5.
Ácido
Un ácido (del latín acidus, que significa agrio) es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7. Esto se aproxima a la definición moderna de Johannes Nicolaus Brønsted y Thomas Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base). Algunos ejemplos comunes son el ácido acético (en el vinagre), el ácido clorhídrico (en el salfumán y los jugos gástricos), el ácido acetilsalicílico (en la aspirina), o el ácido sulfúrico (usado en baterías de automóvil).
Los sistemas ácido/base se diferencian de las reacciones redox en que, en estas últimas hay un cambio en el estado de oxidación. Los ácidos pueden existir en forma de sólidos, líquidos o gases, dependiendo de la temperatura y también pueden existir como sustancias puras o en solución.
Hidróxido
Los hidróxidos son un grupo de compuestos químicos formados por un metal y el grupo funcional OH,(ion hidróxido, OH-), denominado grupo hidroxilo, que actúa con número de oxidación -1. No se puede confundir el ion hidróxido con el radical hidroxilo.
El hidróxido es una combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
Antiguamente a los hidróxidos de los alcalinos y del amonio se los conocía con el nombre de álcalis, pero este término tras la implantación de la nomenclatura moderna se usa más para denominar a cualquier sustancia que presenta carácter alcalino.
Formulación
Los hidróxidos se formulan escribiendo el metal seguido del grupo dependiente con la base de un ion de radical adecuado con hidróxido; este va entre paréntesis si el subíndice es mayor de uno. Se nombran utilizando la palabra hidróxido seguida del nombre del metal, con indicación de su valencia, si tuviera más de una. Por ejemplo, el Ni(OH)2 es el hidróxido de níquel (II) y el Ca(OH)2 es el hidróxido de calcio (véase Nomenclatura química).
Las disoluciones acuosas de los hidróxidos tienen carácter básico, ya que éstos se disocian en el catión metálico y los iones hidróxido. Esto es así porque el enlace entre el metal y el grupo hidróxido es de tipo iónico, mientras que el enlace entre el oxígeno y el hidrógeno es covalente. Por ejemplo:
NaOH(aq) → Na+(aq) + OH-
Los hidróxidos resultan de la combinación de un óxido básico con el agua.4 Los hidróxidos también se conocen con el nombre de bases. Estos compuestos son sustancias que en solución producen iones hidróxido.
Sal
La sal de dicromato de potasio tiene el color naranja brillante característico del anión dicromato.
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el anión, y el ácido el catión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más agua, lo que se denomina neutralización.
Un ejemplo es la sal de mesa, denominada en el lenguaje coloquial sal común, sal marina o simplemente sal. Es la sal específica cloruro de sodio. Su fórmula molecular es NaCl y es el producto de la base hidróxido sódico (NaOH) y ácido clorhídrico, HCl.
En general, las sales son compuestos iónicos que forman cristales. Son generalmente solubles en agua, donde se separan los dos iones. Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad. Fundidas o disueltas en agua, conducen la electricidad.
FASE IV: TALLER DE REPASO Y APLICACIÓN.
Realiza el siguiente experimento casero y lleva tus apuntes a clase:
En esta experiencia vamos a estudiar, utilizando sustancias que puedes encontrar fácilmente en casa, una reacción química en la que se desprenden gases.
Material que vas a necesitar:
Una cucharilla
Bicarbonato del que se vende en las farmacias
Vinagre
Limón
¿Qué vamos a ver?
En la experiencia vamos a ver cómo reacciona el bicarbonato de sodio (NaHCO3) con sustancias que tienen un carácter ácido. Podrás ver cómo se descompone el bicarbonato y se desprende un gas, el dióxido de carbono. Esto ocurre porque el vinagre y el zumo de limón son sustancias que llevan disueltos ácidos: ácido acético, en el caso del vinagre, y ácido cítrico, en el caso del limón.
La reacción química que tiene lugar es la siguiente:
NaHCO3 + HAc —-> NaAc + CO2 + H2O
Los productos que se obtienen son: una sal (NaAc) que queda disuelta en el agua (H2O) y dióxido de carbono (CO2) que al ser un gas burbujea a través del líquido.
¿Qué debes hacer?
Experimento 1
En el fondo de un vaso, o en un plato, coloca un poco de bicarbonato de sodio en polvo.
Deja caer sobre él unas gotas de vinagre. ¿Qué ocurre? Observa el efecto del gas que se desprende.
Repite la experiencia utilizando zumo de limón en vez de vinagre.
Haz otros experimentos para ver si el bicarbonato reacciona con otras bebidas ácidas (por ejemplo, zumo de naranja, zumo de manzana, refresco de cola, etc.).
Experimento 2
Prepara una disolución con 1 cucharadita de bicarbonato en medio vaso de agua.
Utiliza una parte de la disolución para ver cómo reacciona con el vinagre y otra para el zumo de limón.
Repite la experiencia con disoluciones más concentradas de bicarbonato (2, 3 cucharaditas, etc.) y compara los resultados obtenidos con los del caso anterior. ¿Observas diferencias? ¿Cuáles?
Sigue experimentando
Ahora podemos intentar recoger el gas (dióxido de carbono) que hemos obtenido. Para ello vamos a repetir el experimento 2 utilizando una botella, en vez de un vaso, y un globo.
Pon vinagre en una botella.
En un globo pon una cucharadita de bicarbonato.
Sujeta el globo en la boca de la botella, con cuidado para que no caiga el bicarbonato. Ya tenemos preparado el experimento.
Levanta el globo y deja caer el bicarbonato sobre el vinagre. Observa como según se va desprendiendo el dióxido de carbono el globo se va hinchando.
Puedes probar con distintas cantidades de reactivos (vinagre y bicarbonato) y ver cómo varía la presión del gas en el globo.
Tomado de El rincón de la ciencia
Taller
Resuelve en tu cuaderno en grupos de a dos estudiantes:
1. ¿Qué crees que ocurre cuando colocas una pastilla efervescente dentro de un vaso con agua? Describe y explica el fenómeno.
2. ¿Qué consideras que es una reacción química? Explica con un ejemplo.
3. ¿Crees que todas las reacciones químicas son iguales? Menciona los criterios en que apoyas tu respuesta.FASE V: EVALUACIÓN.
Ejercicios para repasar óxidos metálicos.
Une los siguientes cationes metálicos de número de oxidación fijo con el anión óxido.
Catión Metálico Anión Fórmula Nombre
Na1+ O-2
Mg2+
Ca2+
K1+
Cd2+
Ba2+
Zn2+
Al3+
Sr 2+
Cs1+
Hg2+
Co3+
Pb4+
Sn2+
Ni2+
Au3+
Zn2+
Ni3+
Cu1+
Au1+
2. Escribe la fórmula de los siguientes óxidos metálicos.
a) óxido de aluminio _______________ f) óxido cúprico _______________
b) óxido de cobalto(II) _______________ g) óxido de calcio _______________
c) óxido plumboso _______________ h) óxido de litio _______________
d) óxido de estaño(IV) _______________ i) óxido de zinc _______________
e) óxido ferroso _______________ j) óxido de oro(I) ______________
c) Ejercicios para repasar hidróxidos.
3. Une los siguientes cationes metálicos con el anión hidróxido para formar el hidróxido correspondiente.
Catión metálico Anión Fórmula Nombre tradicional
Au1+ OH1-
Pb2+
Ni+2
Co3+
Ca2+
Ni3+
Cu1+
Fe3+
Hg1+
Zn2+
4. Escribe la fórmula de los siguientes hidróxidos.
a) hidróxido de calcio ______________ f) hidróxido cúprico ___________
b) hidróxido de cobre(II) _____________ g) hidróxido de magnesio ___________
c) hidróxido niqueloso ______________ h) hidróxido de cobalto(III) __________
d) hidróxido de aluminio _____________ i) hidróxido auroso ___________
e) hidróxido de mercurio(I) ___________ j) hidróxido plúmbico ___________
ACTIVITIES: Imprimir las guías, resolverlas con lápiz y escanearlas para ser revisadas.DOCENTE: EDGAR RAMIREZ MEJIA
TALLER DE MATEMATICAS GRADO OCTAVO JT
DOC. RODRIGO RAMIREZ T
fotoramirez9306@hotmail.com
octavorodrigo3@gmail.com
INSTITTUCION EDUCATIVA ANGEL MARIA PAREDES
GRADO 8 JM
Realizar los ejercicios propuestos en el cuaderno, con sus respectivos procedimientos.
Luego escanearlos o tomarle fotos que sean visibles y ordenadas, para que
los envíen al siguiente correo matematicasgradonovenoamp@gmail.com.
Luego escanearlos o tomarle fotos que sean visibles y ordenadas, para que
los envíen al siguiente correo matematicasgradonovenoamp@gmail.com.
NOTA: En el asunto escribir lo siguiente. Ejemplo:
Taller de Matemáticas grado ( 801 0 802). Nombre del estudiante.
Números enteros:
Números racionales
ESTADISTICA
TALLER SOCIALES GRADO 8
MARIA RUTH OLIVEROS JT Y JM
alfonso.medina.torres@
mariaruth210@hotmail.com
INSTITUCION EDUCATIVA ANGEL MARIA PAREDES
GUIA DE TRABAJO GEOMETRIA GRADO OCTAVO (8°)
DOCENTE: JOSE EUGENIO POLANIA QUIZA
Correo electrónico: quipo1968@hotmail.com
Desarrolle los siguientes ejercicios:
INSTITUCION EDUCATIVA ANGEL MARIA PAREDES
GUIA DE TRABAJO ESTADISTICA GRADO OCTAVO (8°)
DOCENTE: JOSE EUGENIO POLANIA QUIZA
Correo electrónico: quipo1968@hotmail.com
CONTINUACION
PRIMER PERIODO
FECHA: TEMARIO SEMANA DEL 20 AL 24 DE ABRIL
GRADO: OCTAVO (801-802)
ASIGNATURA: CIENCIAS SOCIALES
DOCENTE: ALFONSO MEDINA TORRES
Enviar al correo: alfonso.medina.torres@hotmail.com
Te
explicamos qué son los ecosistemas y qué tipos de ecosistemas existen. Además,
cómo se componen y algunos ejemplos.
Dentro de cada ecosistema tienen lugar las cadenas
tróficas o alimentarias.
1.
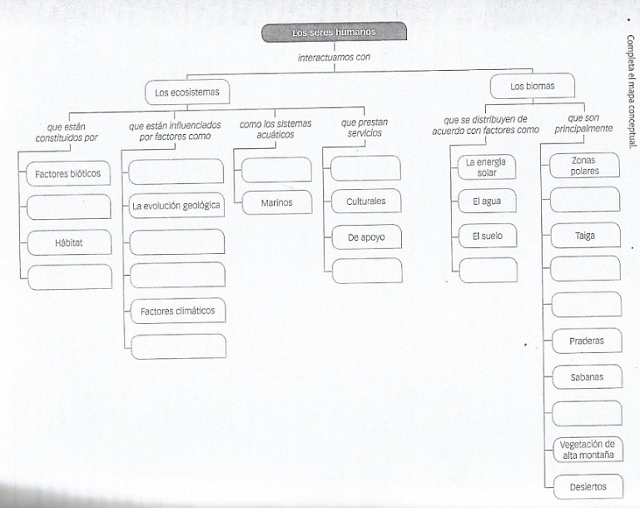
¿Qué es un ecosistema?
Un ecosistema,
en biología, se denomina al engranaje
complejo de relaciones que hay entre las distintas comunidades de organismos vivos
(referidas como biocenosis)
y el medio ambiente físico en el que
viven (llamado hábitat o biotopo). En este concepto tienen
cabida las relaciones de mutua dependencia entre las especies de seres vivos, al igual que el flujo
de energía y
de materia que
ocurre en el medio ambiente; procesos que para su estudio son comprendidos como
un todo estructurado y organizado.
Sin
embargo, no se debe confundir el concepto de ecosistema con el de bioma. Este último se refiere
las distintas áreas o regiones geográficas del planeta Tierra, clasificadas según
su clima, topografía y también su
presencia de vida, a
diferencia de los ecosistemas, los biomas se consideran unidades geográficas
homogéneas. Así, un mismo bioma puede contener diversos ecosistemas
distintos.
Dentro
de cada ecosistema tienen lugar las cadenas tróficas o alimenticias, también entendidas como
ciclos de transmisión de la materia, pues consisten en un circuito de
alimentación que incluye a productores (vegetales,
plantas, fitoplancton, etc.) que se nutren del medio ambiente físico, consumidores que se
alimentan de ellos o de otros consumidores (tanto los herbívoros, como los
depredadores primarios y secundarios) y por último los descomponedores (hongos,
bacterias, etc.) que reciclan la materia orgánica residual.
Actualmente
muchos ecosistemas se hallan en estado de jaque debido a la actividad
industrial humana. La contaminación, sobreexplotación, deforestación y los efectos
del cambio climático implican a menudo
extinciones, sobrepoblaciones, mutaciones y desplazamientos de la vida de todo
tipo, atentando contra la biodiversidad y contra el
equilibrio natural.
2.
Tipos de ecosistema
Existen
diversos tipos de ecosistema, clasificados de acuerdo al hábitat en que se ubican:
·
Ecosistemas acuáticos.
Los más abundantes, casi el 75% de todos los ecosistemas conocidos tienen lugar
bajo el agua.
Es decir: en mares, océanos, ríos, lagos y nichos
submarinos profundos.
·
Ecosistemas terrestres.
Tienen lugar sobre la corteza terrestre y fuera del agua, en sus posibles
variaciones de relieve: montañas, planicies, valles, desiertos,
etc. Esto implica diferencias importantes de temperatura, concentración de
oxígeno y clima,
por lo que la diversidad de la vida en estos ecosistemas es enorme,
mayoritariamente de insectos y de aves.
·
Ecosistemas mixtos.
Aquellos en que se combinan el acuático y el terrestre (anfibio), ya que la
vida animal de estos ecosistemas se halla mayormente en uno de los dos, pero
requieren del otro para reposar, alimentarse o procrear.
·
Ecosistemas microbianos.
Es el de los organismos microscópicos que habitan en prácticamente todos los
medios ambientes, tanto acuáticos como terrestres, e incluso dentro de
organismos mayores, como es el caso de la flora microbiana intestinal.
3.
Componentes de un
ecosistema
Un
ecosistema se integra por dos tipos de elementos, diferentes en su naturaleza:
los bióticos y lo abióticos:
·
Los elementos bióticos son
aquellos vinculados a la vida en sus numerosas formas y tendencias, como las
relaciones tróficas, la presencia vegetal, los equilibrios poblacionales, etc.
·
Los elementos abióticos,
en cambio, son los referidos a las condiciones climáticas, de relieve, o
de otras variantes químicas y/o físicas que atañen al medio ambiente, como la
variación del pH,
la presencia de luz solar, etc.
4.
Ejemplos de ecosistema
·
Arrecifes coralinos.
De las más grandes concentraciones de vida en el mundo submarino, tiene lugar
dentro y alrededor de las estructuras coralinas que forman una barrera natural.
Hay numerosas las especies pequeñas (peces, crustáceos, moluscos) debido a la
abundancia de materia orgánica, sirviendo a su vez de alimento para
depredadores.
·
Zonas abisales submarinas.
Ecosistemas extremos, de poca presencia animal y nula presencia vegetal, pues
la ausencia de luz solar impide la fotosíntesis.
La vida sin embargo se adapta a la enorme presión del agua y a la baja cantidad
de nutrientes. Mucha de ella se sostiene a partir de una lluvia constante de
materia orgánica proveniente de la superficie, o a través de la quimiosíntesis.
·
Ecosistemas polares.
Se caracteriza por temperaturas muy bajas y de poca humedad atmosférica. A pesar
de ello posee un mar rico en plancton y vida animal adaptada a las aguas
heladas: cuerpos peludos, densas capas de grasa, etc.
·
Ecosistemas lóticos. Tienen
lugar dentro y en los márgenes de los ríos, arroyos o manantiales que hay la
superficie terrestre. La vida en ellos se adapta al flujo del agua, que
arrastra consigo nutrientes, químicos, especies vivientes o simplemente agua
muy oxigenada en su movimiento.
DESARROLLA LAS SIGUIENTES PREGUNTAS:
1. ¿Qué importancia tienen los
ecosistemas acuáticos en Colombia, para las especies animales?
2. ¿Qué función cumplen las especies
vegetales que se desarrollan en los ecosistemas acuáticos Colombianos?
3. ¿Qué elementos crees que existen en
común entre los páramos, los humedales y los manglares?
4. ¿Porque son importantes los páramos
para los seres vivos? Nombre dos ejemplos.
5. Elabora un escrito sobre los
ecosistemas.
6. Elabora un mapa conceptual de los
ecosistemas.




Profes no era que estábamos en vacaciones
ResponderBorrarJajajajaja
BorrarEste comentario ha sido eliminado por el autor.
Borrarprofe no se puede ver el estadísticas
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarBuenos días profesores. Las entrega de los trabajos todos tiene fecha de entrega, por que solo veo el de la profe América que dice 27 marzo
ResponderBorrarbuenos tardes profesores estos trabajos donde se realizan en los cuaderno o hay que imprimirlos y enviarlos a esos correo que escribieron
ResponderBorrarBueno uno necesita una guía o orientación sobre los trabajos para nuestros hijos pero no hay respuestas,hay qué imprimir o hacerlos en cuaderno y enviar imágen a los correos correspondiente, otra cosa por que los enviaron en otro formato más entendible, un PDF, o inclusive en word para poder resolverlos con esas herramientas y sería más fácil enviar.
ResponderBorrarhacer los en cuadernos y enviar fotos a correos o imptimirlos
ResponderBorrarNo seria mejor hacer clases virtuales cortas?¿
BorrarY que expliquen cada tema de lo que trata y desarrollarlo en World e imprimirlo, lo mas curioso es que envía los trabajos en un formato no entendible, seria mas fácil con World o Office?
hola
Borraryo lo estoy haciendo en Word no hay problema o que
ResponderBorrarNo carga lo de estadistica no carga
ResponderBorrarProfesor Eugenio no cargan las guias de estadística y de geometría
ResponderBorrarhola profesores buenos dias todos los tallerres hay que contestarlos en los cuaderno o en una hoja a parte
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarNo carga las de estadística
ResponderBorrar